Medicinsk ekspert af artiklen
Nye publikationer
Rabies hos børn
Sidst revideret: 04.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Rabies, eller hydrofobi, er en akut virussygdom, der overføres gennem bid fra et inficeret dyr, med skade på nervesystemet og udvikling af alvorlig hjernebetændelse med dødelig udgang.
Epidemiologi
Rabiesvirus, der siden oldtiden har været en folkesundhedsplage, forårsager i øjeblikket cirka 59.000 menneskelige dødsfald hvert år, hvoraf næsten alle overføres via hundebid. Dette har en betydelig økonomisk indvirkning på udviklingslande, især i Afrika og Asien, som kan lide de mindste sådanne tab. Trods sin næsten 100% dødelighed er hunderabies en fuldstændig forebyggelig sygdom, og historiske eksempler på udryddelse af hunderabies i de udviklede lande vidner om dette. [ 1 ]
Årsager Rabies
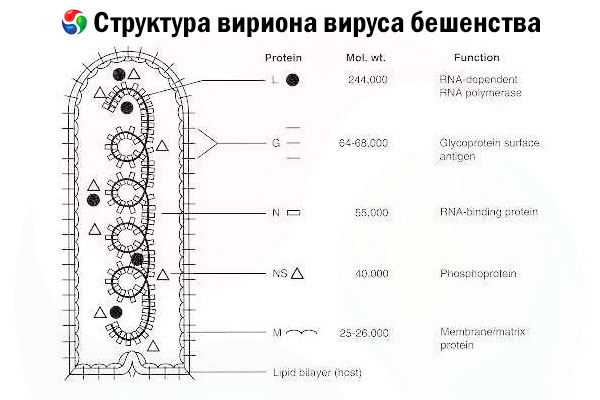
Det forårsagende agens er rabiesvirus (RV), en negativstrenget RNA-virus af rhabdovirusfamilien, der er cirka 60 nm × 180 nm i størrelse.
Den består af en indre proteinkerne, eller nukleokapsid, der indeholder nukleinsyre, og en ydre membran, et lipidholdigt dobbeltlag dækket med transmembrane glykoproteinpigge. Den har en relativt simpel modulær genomstruktur og koder for fem strukturelle proteiner:
- RNA-afhængig RNA-polymerase (L),
- nukleoprotein (N),
- fosforyleret protein (P),
- matrixprotein (M) og
- ydre overflade glykoprotein (G).
N-, P- og L-proteinerne danner sammen med det genomiske RNA ribonukleoproteinkomplekset. G er det eneste RV-antigen, der er i stand til at inducere produktionen af RV-neutraliserende antistoffer, som er de vigtigste immuneffektorer mod dødelig RV-infektion. På den anden side har ribonukleoproteinkomplekset vist sig at være det vigtigste RV-antigen, der er i stand til at inducere CD4+ T-celler, hvilket kan forstærke produktionen af RV-neutraliserende antistoffer gennem intrastrukturel antigengenkendelse.[ 2 ] Ribonukleoproteinkomplekset kan spille en vigtig rolle i etableringen af immunologisk hukommelse og langvarig immunitet.[ 3 ]
Klassificering og antigentyper
Slægten Lyssavirus omfatter rabiesvirus og antigenisk og genetisk beslægtede rabiesvirus: Lagos-, Mokola- og Duvenhage-flagermusvirus, samt to formodede undertyper af europæiske flagermuslyssavirus. Krydsbeskyttelsesstudier indikerer, at dyr immuniseret med traditionelle rabiesvacciner muligvis ikke er fuldt beskyttet, når de udsættes for andre lyssavirus.
Rabiesvirus kan klassificeres som fikserede (tilpasset ved passage i dyr eller cellekultur) eller gadevirus (vildtype). Brugen af monoklonale antistoffer og genetisk sekventering til at differentiere gadevirus har hjulpet med at identificere virusvarianter, der stammer fra store værtsreservoirer verden over, og med at foreslå sandsynlige kilder til menneskelig eksponering, når en historie med et definitivt dyrebid ellers var fraværende hos en patient.[ 8 ]
Patogenese
Den primære kilde til infektion blandt vilde dyr er ulve, ræve, sjakaler, flagermus, og blandt husdyr - hunde og katte, sjældent - heste, kvæg, svin, rotter osv. Overførsel af infektion fra person til person er, selvom mulig, ekstremt sjælden. Dette er en typisk zoonotisk infektion. Mennesker bliver primært smittet med rabies fra hunde.
Efter et menneske er blevet bidt af et sygt dyr, formerer virussen sig i muskelvævet på bidstedet, og når den når enderne af de sensoriske perifere nerver, spreder den sig centripetalt og når motorneuronerne. Den tid det tager for virussen at bevæge sig og påvirke hjernen afhænger af bidstedet. Ved alvorlige bid i hoved og ansigt kan virussen nå centralnervesystemet på 15-20 dage, og ved mindre skader på huden på kroppen og lemmerne og dermed en lille dosis af patogenet kan processen med at overføre virussen til centralnervesystemet forsinkes i flere måneder eller endda op til 1-1,5 år. Når virussen når centralnervesystemet, er den fikseret i hjernens og rygmarvens væv, primært i neuronerne i medulla oblongata, ammoniumhornet og hjernens bund. I rygmarven er de bageste horn mest påvirket. Fra centralnervesystemet når virussen centrifugalt langs nervestammerne spytkirtlerne, hvor den formerer sig og udskilles med spyt.
Begreber i patogenesen af rabies
RV har en bred værtsgruppe og kan inficere næsten alle pattedyr. Selvom der er rapporteret om flere RV-smitteveje, forekommer naturlig infektion oftest via et bid. Ud over bid kan indtagelse af RV-inficerede kadavere fremme rabiesvirusinfektion hos polarræve, og kontakt mellem RV og slimhinder har vist sig at være en anden mulig smittevej.[ 9 ] Under nogle usædvanlige omstændigheder, såsom utilsigtet frigivelse af RV som en aerosol i et laboratorium eller RV som en aerosol i huler beboet af et stort antal flagermus,[ 10 ] kan aerosolsmitte forekomme.
Det er endnu ikke klart, om gade-RV og muse-adapterede eller vævskultur-adapterede RV-stammer replikerer på inokulationsstedet, før de kommer ind i CNS. Mens eksperimentel intramuskulær infektion af unge hamstere eller vaskebjørne med gade-RV afslørede RV-replikation i tværstribede muskelceller, før virussen invaderede motorneuronaxoner på tværs af neuromuskulære forbindelser,[ 11 ],[ 12 ] viste intramuskulær infektion af mus med muse-adapteret CVS-24 RV, at RV migrerer direkte til CNS uden forudgående replikation på inokulationsstedet.[ 13 ] Når RV er i terminalerne af umyeliniserede axoner, transporteres det retrogradt til cellekroppen.
Nylige resultater tyder på, at aksonal vesikeltransport kan repræsentere en nøglestrategi for virionbevægelse over lange afstande i axoner.[ 14 ] Det er blevet anslået, at RV migrerer inden for axoner med en hastighed på 3 mm/t.[ 15 ] Infektionen spredes derefter gennem en kæde af neuroner forbundet af synaptiske forbindelser. Den nøjagtige mekanisme, der fremmer transsynaptisk spredning, er dog stadig ukendt. Efter at have inficeret hjernen spredes virussen centrifugalt til det perifere og autonome nervesystem i mange perifere organer.[ 16 ] I den sidste fase af infektionscyklussen migrerer RV til spytkirtlerne; efter replikation i mukogene acinære celler frigives den i spyttet og er klar til transmission til den næste vært.[ 17 ]
Med hensyn til rabiesvirus-induceret patologi er apoptotisk celledød blevet foreslået som en potentiel patogen mekanisme i eksperimentelle rabiesmodeller af mus inficeret med en fikseret stamme af RV.[ 18 ] En patogen mekanisme, der kan bidrage til den dybe CNS-dysfunktion, der er karakteristisk for rabies, kan være nedsat neuronal funktion. Genekspression har vist sig at være markant reduceret i RV-inficerede neuroner, hvilket resulterer i en generel undertrykkelse af proteinsyntese,[ 19 ] og adskillige undersøgelser har vist nedsat neurotransmission efter RV-infektion. Jiang demonstrerede, at binding af en acetylcholinreceptorantagonist til inficerede rottehjernehomogenater var reduceret sammenlignet med kontrolpersoner.[ 20 ] Nedsat frigivelse og binding af serotonin, en neurotransmitter involveret i kontrollen af søvncyklus, smerteopfattelse og adfærd, blev også observeret i RV-inficeret rottehjerne. [ 21 ], [ 22 ] Ud over at påvirke neurotransmission kan højre ventrikelinfektion også påvirke ionkanaler. Inficerede museneuroblastomceller udviser nedsat funktionel ekspression af spændingsstyrede natriumkanaler, hvilket kan forhindre aktionspotentialer og i sidste ende føre til funktionel svækkelse. [ 23 ]
Ud over fraværet af alvorlige patologiske læsioner i centralnervesystemet (CNS), udløser de fleste tilfælde af rabies hos mennesker ikke et immunrespons 7 til 10 dage efter de kliniske tegns opståen. Disse markante forskelle mellem patogenesen af rabies og patogenesen af de fleste andre virale eller bakterielle CNS-infektioner understøttes yderligere af det faktum, at immunsuppression enten er ineffektiv eller skadelig for resultatet af rabies. [24] Det lave niveau af immunrespons, der ofte observeres hos rabiesofre, er forvirrende, fordi det ikke kan forklares med den dårlige immunogenicitet af RV-antigener. Faktisk er RV G og nukleokapsidprotein potente B- og T-celleantigener, når de administreres parenteralt. [ 25 ] En mulig forklaring på den lave grad af immunrespons mod RV hos mennesker eller dyr med rabies kan være, at RV-infektion i CNS forårsager immunsuppression, [ 26 ], og det er blevet foreslået, at RV bruger en subversiv strategi, herunder at forhindre apoptose og ødelægge invaderende T-celler. [ 27 ]
Svækkede RV-stammer, der er blevet tilpasset til ikke-neuronale celler, adskiller sig markant fra patogene gade-RV-stammer i deres neuroinvasivitet, hvilket refererer til deres evne til at invadere CNS fra perifere steder. I denne henseende mangler eller har vævskultur-tilpassede RV-stammer kun begrænset evne til at invadere CNS fra perifere steder, hvorimod gade-RV-stammer eller muse-tilpassede RV-stammer såsom CVS-24 er meget invasive.[ 28 ] Nøglefaktorer involveret i RV-neuroinvasion omfatter viral optagelse, axonal transport, transsynaptisk spredning og viral replikationshastighed.
Indtil for nylig var vores viden om RV-patogenese begrænset og primært baseret på beskrivende studier af RV-stammer på gaden eller eksperimentelle infektioner med svækkede stammer, der er tilpasset i laboratoriet. Fremkomsten af omvendt genetik-teknologi har gjort det muligt for os at identificere de virale elementer, der bestemmer den patogene fænotype af RV, og bedre at forstå de mekanismer, der er involveret i rabiespatogenese.
Identifikation af virale elementer, der kontrollerer erhvervelse, spredning og replikation af rabiesvirus
- Virale elementer involveret i virusfangst
RV-infektion begynder med virussens binding til en formodet cellulær receptor. Selvom adskillige membranoverflademolekyler er blevet foreslået som RV-receptorer, herunder den nikotiniske acetylcholinreceptor,[ 29 ] det neurale celleadhæsionsmolekyle[ 30 ] og den lav-affine neurotrofinreceptor p75 NTR,[ 31 ] er det stadig uklart, om disse molekyler rent faktisk spiller en rolle i rabiesvirussens livscyklus. I denne sammenhæng er det for nylig blevet vist, at RV G-p75 NTR-interaktionen ikke er nødvendig for RV-infektion af primære neuroner.[ 32 ] Efter receptorbinding internaliseres RV via adsorptiv eller receptormedieret endocytose. [ 33 ] Det lave pH-miljø i det endosomale rum inducerer derefter konformationsændringer i RV G, der udløser fusion af virusmembranen med den endosomale membran, hvorved RNP frigives i cytoplasmaet. [ 34 ] For virus spiller RV G en kritisk rolle i virusoptagelse, sandsynligvis gennem interaktioner med formodede cellulære receptorer, der fremmer hurtig optagelse. I denne henseende er det blevet vist, at patogeniciteten af vævskultur-adapterede RV-stammer (f.eks. ERA, HEP og CVS-11) korrelerer med tilstedeværelsen af en determinant placeret i antigenisk sted III af G-proteinet. [ 35 ] En Arg → Gln-mutation i position 333 i dette antigeniske sted af ERA G-proteinet resulterede i en syv gange forsinkelse i internaliseringen af Gln333 RV-varianten sammenlignet med vildtypevarianten. Asn194→Lys194-mutationen i RV G, som forklarer genopblussen af den patogene fænotype, var forbundet med et signifikant fald i internaliseringstiden.[ 36 ] Desuden viste eksperimenter med kimære RV'er, at den tid, der kræves til internalisering af RV-virioner, var signifikant forøget, og patogeniciteten var stærkt reduceret efter udskiftning af G-genet fra den højpatogene SB RV-stamme, som var afledt af en cDNA-klon af den sølvafledte flagermusassocierede stamme RV-18,[ 37 ] med genet fra den højt svækkede SN-stamme, som blev isoleret fra en cDNA-klon af SAD B19 RV-vaccinestammen.[ 38 ] Samlet set understøtter disse data den opfattelse, at kinetikken for virusoptagelse, som er en funktion af RV G, er en væsentlig faktor for RV-patogenicitet.
- Virale elementer involveret i spredning og transmission af virus
En unik egenskab ved rabiesvirus er dens evne til at sprede sig fra celle til celle. Observationen af, at Gln333 ERA-varianten mister pH-afhængig celle-celle-fusionsaktivitet in vitro [ 39 ] og udviser en stærkt reduceret evne til at sprede sig fra celle til celle [ 40 ], antyder, at RV G også spiller en nøglerolle i celle-til-celle-spredning og dermed virusoverførsel, sandsynligvis gennem dens fusiogene aktivitet. Denne mulighed understøttes yderligere af fundene om, at spredningshastigheden for den patogene RV-revertant SPBNGAK er næsten dobbelt så høj som den, der er bestemt for den ikke-patogene SPBNGA-variant. Interessant nok forårsagede Asn 194 → Lys 194-mutationen i G SPBNGAK et skift i pH-tærsklen for membranfusion til en højere pH, hvilket understøtter hypotesen om, at en højere pH-tærskel for membranfusion er forbundet med øget virusspredning. [ 41 ]
Studier af transneuronale indikatorer for RV-infektion hos rotter [ 42 ] og rhesusaber [ 43 ] har vist, at rabiesvirus udelukkende migrerer i en retrograd retning i axoner. Selvom adskillige RV-proteiner er involveret i neuronale transportmekanismer, ser RV G ud til at spille en dominerende rolle i den transneuronale spredning af RV-infektion. For eksempel, mens perifer infektion med equine infectious anemia virus (EIAV) pseudotypet med RV G resulterer i virusoverførsel til rygmarven, trængte den samme EIAV pseudotypet med vesikulær stomatitis virus G ikke ind i nervesystemet. [ 44 ] Desuden blev virusspredningen af ERA G Arg 333 → Gln 333-mutanten i CNS fundet stærkt reduceret sammenlignet med vildtypemutanten, hvilket yderligere tyder på en funktion af intakt RV G i transsynaptisk spredning. Det mest overbevisende bevis for en vigtig rolle af RV G i transsynaptisk transport kommer imidlertid fra intrakraniel infektion af mus med en rekombinant G-defekt RV-virus, som viste, at infektionen forblev begrænset til neuroner på inokulationsstedet uden tegn på spredning til sekundære neuroner.[ 45 ] Det er dog sandsynligt, at udover RV G spiller RV M også en rolle i virusspredning og dermed i transsynaptisk transport. I denne henseende blev det vist, at spredningen af den kimære SN-BMBG RV-variant, som indeholder både M og G fra den højpatogene SB, var signifikant højere end spredningen af den kimære SN-BG- eller SN-BM-variant, som indeholder henholdsvis G og M fra SB, hvilket tyder på, at optimal interaktion mellem M og G kan spille en vigtig rolle i celle-til-celle-virusspredning. [ 46 ] Da RV M understøtter virusknoppskydning, [ 47 ] er det sandsynligt, at den mere effektive spredning af den kimære RV SN-BMBG-variant skyldes optimal virusknoppskydning ved den postsynaptiske membran.
Nyere undersøgelser har vist, at interaktionen mellem RV P og dynein-lette kæder forbinder RV RNP til værtscellens transportsystem, hvorved retrograd axonal transport af virusset fremmes. [ 48 ], [ 49 ] Perifer infektion af voksne mus viste imidlertid, at deletion af LC8-bindingsdomænet i RV P ikke forhindrer virus i at komme ind i CNS, hvilket tyder på, at RV-proteinet ikke er direkte involveret i retrograd axonal spredning af RV. [ 50 ]
- Virale elementer, der kontrollerer viral replikation
I modsætning til mange andre vira, såsom influenzavirus, er RV-patogenicitet omvendt proportional med hastigheden af viral RNA-syntese og produktion af infektiøse viruspartikler. Sammenligning af viralt mRNA og genomisk RNA-niveauer produceret af forskellige kimære vira tyder på, at viral RNA-transkription og -replikation reguleres af flere faktorer, herunder RV M, som er blevet identificeret som en trans-virkende faktor, der medierer skiftet fra initialt høje niveauer af mRNA-syntese til genomisk RNA-syntese.[ 51 ] Desuden er M fra alle rhabdovirus i stand til at lukke for viral genekspression ved at binde til RNP, hvilket resulterer i dannelsen af en stærkt kondenseret rygradslignende struktur, der ikke er i stand til at understøtte RNA-syntese.
For at identificere andre virale elementer, der kontrollerer patogenicitet ved at regulere viral replikation, blev 5'-terminalsekvenserne af den højpatogene SB-stamme trinvis erstattet med sekvenser fra den højt svækkede SN-vaccinestamme, hvilket resulterede i rekombinante vira SB2 (terminalsekvens [TS] + L), SB3 (TS + L + pseudogen [Ψ]), SB4 (TS + L + Ψ + G) og SB5 (TS + L + Ψ + G + M). Intramuskulær infektion med de forældre SB- og SN-vira og de kimære RV'er SB2, SB3, SB4 og SB5 medførte den højeste dødelighed hos SB-inficerede mus og ingen morbiditet eller mortalitet hos SN-inficerede mus. Erstatning af TS, L og SB med de tilsvarende elementer fra SN resulterede i en beskeden reduktion i morbiditet og mortalitet, og en yderligere G- eller G- plus M-udveksling reducerede kraftigt eller ophævede fuldstændigt viral patogenicitet.
Fænotypisk karakterisering af disse vildtype- og kimære RV'er i vævskultur viste, at patogeniciteten af en given RV er omvendt korreleret med dens evne til at replikere i neuronale celler. Selvom SB replikerede på niveauer næsten 1000 gange lavere end SN, og erstatning af TS, L og i SB med SN-niveauer havde ringe effekt på viral vækstkinetik, resulterede yderligere erstatning af G eller G plus M af SB med de tilsvarende SN-gener i en 1-log stigning i virusproduktion, hvilket tyder på, at viral RNA-replikationskinetik såvel som viral partikelproduktion i vid udstrækning kontrolleres af RV G-proteinet. Denne konklusion understøttes af data opnået med RV G-varianter, der adskiller sig med én aminosyre i deres G-proteiner. Den patogene rabiesvirusvariant SPBNGAK 194 producerede en virustiter i NA-celler, der var 1 log lavere end den, der blev produceret af den ikke-patogene variant SPBNGAN 194, og realtids-PCR-analyse viste, at raterne for viral RNA-transkription og -replikation i SPBNGAK-inficerede NA-celler var 5 og 10 gange højere end i SPBNGAK-inficerede NA-celler.[ 52 ] Yderligere beviser for en omvendt korrelation mellem patogenicitet og hastigheden af viral RNA-syntese og viral partikelproduktion blev leveret af mus inficeret med kimære rekombinante vira, hvor G- og M-generne fra den svækkede SN-stamme blev erstattet af generne fra den højpatogene SB-stamme. Disse eksperimenter afslørede en signifikant stigning i patogeniciteten af den forældre-SN-stamme, der bærer RV G, i forhold til den patogene SB-stamme. Patogeniciteten blev yderligere forøget, når både G og M fra SB blev introduceret i SN.
Substitution af G eller M eller begge i SN med de tilsvarende gener fra SB var forbundet med et signifikant fald i hastigheden af viruspartikelproduktion såvel som hastigheden af virus-RNA-syntese. Disse data indikerer, at både G og M spiller vigtige roller i RV-patogenesen ved at regulere virusreplikation. Fundet om, at substitution af G eller G plus M i SN med G eller G plus M af SB resulterer i et moderat til stærkt fald i henholdsvis virus-RNA-transkription og -replikation, mens substitution af M alene i SN med M af SB resulterer i en stærk stigning i virus-RNA-transkription og -replikation, indikerer, at RV G også har en vigtig regulatorisk funktion i virus-RNA-transkription/replikation enten alene eller gennem interaktion med M-proteinet. Mekanismen, hvorved RV G-genet kontrollerer virus-RNA-syntese, er ukendt. Visse nukleotidsekvenser inden for RV G-generne, såsom dem, der inkluderer kodonerne for Arg333 og Lys 194, er blevet identificeret som mål for cellulære miRNA'er. Det er blevet vist, at målgenkendelse af cellulære miRNA'er kan resultere i positiv eller negativ regulering af virusreplikation. [ 53 ] Arg 333 → Glu 333 eller Lys 194 → Ser 194 substitutioner i RV G-gensekvensen resulterer i afskaffelsen af miRNA-målsekvenser, hvilket igen er forbundet med en signifikant stigning i hastigheden af viral RNA-syntese [Faber M, Thomas Jefferson University, PA, USA, upublicerede data], hvilket tyder på, at værtens cellulære miRNA'er også spiller en vigtig rolle i reguleringen af RV-replikation, som det er blevet vist for andre RNA-vira, herunder vesikulær stomatitisvirus og HCV. [ 54 ], [ 55 ]
Regulering af viral replikation synes at være en af de vigtige mekanismer involveret i RV-patogenesen. For at undgå immunresponset og bevare integriteten af det neuronale netværk kan patogene RV-stammer, men ikke svækkede stammer, regulere deres vækstrate. En lavere replikationsrate gavner sandsynligvis patogene RV-stammer ved at bevare den neuronale struktur, som disse vira bruger til at nå CNS. En anden forklaring på den lavere replikationsrate for patogene RV er, at virussen for at undgå tidlig detektion af værtens immunsystem opretholder minimale niveauer af ekspression af sine antigener.
Forholdet mellem RV G-ekspression, apoptose og patogenicitet
Det er velkendt, at street rabiesvirusstammer, der er signifikant mere patogene end vævskultur-adapterede stammer, udtrykker meget begrænsede niveauer af G og ikke inducerer apoptose før sent i den infektionscyklus, hvilket tyder på, at patogeniciteten af en bestemt virusstamme er omvendt korreleret med RV G-ekspression og evnen til at inducere apoptose.[ 56 ] Direkte beviser for en korrelation mellem niveauet af G-ekspression og omfanget af apoptose blev opnået med den rekombinante RV SPBNGA-GA, som bar to identiske G-gener og overudtrykte RV G.[ 57 ] Morfologiske undersøgelser af neuronale kulturer inficeret med denne rekombinante RV viste, at celledød var signifikant forøget parallelt med RV G-overekspression, og at apoptose er den primære mekanisme involveret i RV G-medieret død. Især faldet i F-actin-farvning efter SPBNGA-GA-infektion er i overensstemmelse med apoptose-induceret depolymerisering af actinfilamenter. Desuden var antallet af TUNEL-positive kerner i SPBNGA-GA-inficerede neuroner signifikant forøget sammenlignet med antallet i uinficerede og SPBNGA-inficerede neuroner. Mekanismen, hvorved RV G-genet medierer den apoptotiske signaleringsproces, er dog stadig stort set ukendt. Det er blevet foreslået, at RV G-ekspression over en vis tærskel alvorligt forstyrrer cellemembranen. Det er meget sandsynligt, at apoptotiske celler ikke fjernes hurtigt i CNS og derfor undergår sekundær nekrose. [ 58 ] På den anden side kan RV-infektion og især RV G-proteinoverekspression føre til pyroptose, en celledødsvej svarende til apoptose, der i modsætning til apoptose involverer aktivering af caspase 1 og derved fører til nekrose. [ 59 ] Graden af nekrose eller pyroptose induceret af RV-infektion spiller sandsynligvis en kritisk rolle i induktionen af antiviral immunitet. Mens apoptotiske celler opretholder deres membranintegritet og ikke stimulerer det medfødte immunrespons, bliver nekrotiske celler permeabiliserede og udskiller endogene adjuvanser, der kan udløse et robust medfødt immunrespons. [ 60 ]
Da niveauet af apoptose/nekrose korrelerer med RV-immunogenicitet, er det blevet foreslået, at den immunstimulerende effekt af apoptotiske/nekrotiske celler højst sandsynligt bidrager til dannelsen af et beskyttende immunrespons. Derfor er regulering af RV G-ekspression meget sandsynligt en vigtig faktor i rabiespatogenese, da det giver et middel til overlevelse og spredning af patogene RV-varianter i nervesystemet uden at forårsage åbenlys neuronal skade og fremkalde et beskyttende immunrespons, der ville forhindre infektion.
RV G-ekspression kan reguleres på niveauet af RNA-syntese, det posttranslationelle niveau eller begge dele. Niveauerne af RV G udtrykt af forskellige kimære RV-varianter har vist sig at være afspejlet af hastigheden af viral RNA-syntese, hvilket tyder på, at differentiel regulering af RV G-ekspression af disse varianter skyldes variationer i hastigheden af viral mRNA-transkription. Som med virale RNA-transkriptionshastigheder korrelerer mængden af RV G udtrykt af disse varianter omvendt med viral patogenicitet. På den anden side resulterede infektion af primære neuronale kulturer med den mindre patogene RV-variant CVS-B2c i fire gange højere niveauer af G-protein end infektion med den højpatogene variant CVS-N2c, på trods af syntesen af sammenlignelige niveauer af G mRNA i begge infektioner. Puls-chase-eksperimenter viste, at de højere G-proteinniveauer i CVS-B2c-inficerede neuroner i vid udstrækning var et resultat af en lavere nedbrydningshastighed af CVS-B2c G-proteinet sammenlignet med CVS-N2c G-proteinet. Imidlertid er den mekanisme, der fører til den hurtigere proteolytiske nedbrydning af CVS-N2c G-proteinet, stadig uafklaret.
Symptomer Rabies
Inkubationstiden for rabies er i gennemsnit 30-90 dage. Ved massiv infektion gennem store sår i hoved og ansigt kan den forkortes til 12 dage. I sjældne tilfælde kan inkubationstiden vare 1 år eller mere.
Der er en strengt sekventiel ændring af tre perioder af sygdommen: prodromal, excitation, lammelse.
Prodromperioden begynder med forekomsten af ømning eller trækkende smerter på bidstedet, samt smerter langs nerverne. I arret kan der være en brændende fornemmelse, kløe, undertiden rødme og hævelse. Patienten oplever generel utilpashed, hovedpine, kvalme. Opkastning, en stigning i kropstemperatur til 37,5-38 ° C og symptomer på en progressiv psykisk lidelse bemærkes: øget refleksophidselse, en uforklarlig følelse af angst, frygt, melankoli. Ofte er patienten deprimeret, hæmmet, tilbagetrukket, nægter at spise, sover dårligt, klager over dystre tanker, skræmmende drømme. Prodromperioden varer 2-3 dage, nogle gange forlænges til 7 dage. Ved afslutningen af denne periode kan der være anfald af angst med kortvarige vejrtrækningsbesvær, en følelse af trykken for brystet, ledsaget af takykardi og øget respirationsfrekvens.
Perioden med ophidselse er præget af forekomsten af hydrofobi: når patienten forsøger at drikke, og derefter ved synet af vand eller en påmindelse om det, oplever han en krampagtig spasme i svælget og strubehovedet, hvor han kaster kruset med vand væk med et skrig, kaster rystende hænder fremad, kaster hoved og krop tilbage. Nakken strækkes ud, en smertefuld grimasse forvrænger ansigtet, som bliver blåligt på grund af spasmer i åndedrætsmusklerne. Øjnene buler ud, udtrykker frygt, tigger om hjælp, pupillerne udvides, indånding er vanskelig. På anfaldets højdepunkt er hjerte- og åndedrætsstop muligt. Anfaldet varer i flere sekunder, hvorefter patientens tilstand synes at forbedres. Efterfølgende kan anfald af spasmer i musklerne i strubehovedet og svælget forekomme selv fra luftbevægelse (aerofobi), stærkt lys (fotofobi) eller et højt ord (akustikofobi). Anfaldene ledsages af psykomotorisk agitation, hvor patienten opfører sig som en "galning". Bevidstheden er sløret under anfaldet, men klarner op i den interiktale periode. I perioden med agitation oplever patienterne, på grund af øget tonus i det sympatiske nervesystem, en kraftig stigning i spytproduktionen (sialorrhea) med manglende evne til at synke spyt på grund af spasmer i svælgmusklerne. Patienten sprøjter spyt. Nogle patienter kan udvikle tegn på meningisme og endda opisthotonus, og kramper er almindelige. I dette tilfælde ændrer cerebrospinalvæsken sig muligvis ikke, men hos nogle patienter kan proteinkoncentrationen stige, og antallet af celler kan stige på grund af lymfocytter.
Uden tilstrækkelig behandling øges tegn på dehydrering, ansigtstrækkene bliver skarpere, og kropsvægten falder. Kropstemperaturen stiger til høje værdier. Krampetrækninger er mulige. Varigheden af excitationsstadiet er omkring 2-3 dage, sjældent 4-5 dage. Et dødeligt udfald forekommer normalt under et af anfaldene. I sjældne tilfælde overlever patienten til sygdommens tredje fase.
I lammelsesperioden falder patienten til ro. Anfald af hydrofobi ophører, patienten kan drikke og synke mad, bevidstheden er klar. Trods det tilsyneladende velbefindende øges sløvhed, apati, depression, lammelse af lemmerne, bækkenforstyrrelser og lammelse af kranienerverne opstår snart. Kropstemperaturen stiger til 42-43 °C, arterietrykket falder, og ved udgangen af den første dag indtræffer døden som følge af lammelse af de kardiovaskulære og respiratoriske centre.
Neutrofil leukocytose, forhøjet hæmoglobin, erytrocytter og hæmatokrit observeres i det perifere blod.
Hvad generer dig?
Forms
Klinisk skelnes der mellem typiske og atypiske former. Atypiske former omfatter alle tilfælde uden ophidselse og hydrofobi. Atypiske former omfatter bulbær, cerebellær, meningoencefalitisk osv.
Diagnosticering Rabies
Påvisning af rabiesantigen, antistoffer, viralt RNA eller virusisolering muliggør diagnosen rabies. Da enhver individuel test kan være negativ hos en patient med rabies, er serielle serumprøver til påvisning af rabiesantistoffer, spytprøver til viruskultur og hudbiopsi til direkte immunofluorescenstest for viralt antigen nogle gange nødvendige, især når der er stærk mistanke om rabies.
En af de hurtigste metoder til at diagnosticere rabies før døden hos mennesker er at udføre en direkte immunofluorescenstest på en hudbiopsi i nakken for at detektere rabiesantigen. Den direkte immunofluorescenstest er den mest følsomme og specifikke metode til at detektere rabiesantigen i hud og andet frisk væv (f.eks. hjernebiopsi), selvom resultaterne lejlighedsvis kan være negative tidligt i sygdommen. Hvis frisk væv ikke er tilgængeligt, kan enzymatisk fordøjelse af fikseret væv øge immunofluorescenstestens reaktivitet; følsomheden kan dog være uacceptabelt lav.
Diagnosen kan også stilles, hvis virussen isoleres fra spyt efter podning af neuroblastomceller eller laboratoriegnavere; dette er normalt mest effektivt i løbet af de første 2-3 uger af sygdommen. Påvisning af rabiesvirusneutraliserende antistoffer, normalt udført ved hjælp af den hurtige fluorescerende fokusinhibitionstest (RFFIT), i serum fra uvaccinerede individer er også diagnostisk. Tilstedeværelsen af antistoffer i cerebrospinalvæsken bekræfter diagnosen, men de kan forekomme 2-3 dage senere end serumantistoffer og kan derfor være mindre nyttige i de tidlige stadier af sygdommen. Mens det serologiske respons efter vaccination generelt ikke kan skelnes fra det serologiske respons, der induceres af sygdommen, producerer vaccination normalt ikke antistoffer mod cerebrospinalvæsken.
Kun syv tilfælde af rabies-"helbredelse" i de sidste 25 år er veldokumenterede. Selvom rabiesvirus ikke blev isoleret fra nogen af patienterne, understøttede høje titere af rabiesneutraliserende antistoffer i serumprøver og tilstedeværelsen af neutraliserende antistoffer i cerebrospinalvæsken stærkt diagnosen.
Hvad skal man undersøge?
Hvilke tests er nødvendige?
Differential diagnose
Diagnosen rabies hos mennesker stilles normalt på baggrund af epidemiologiske og kliniske data og bekræftes i laboratoriet. Diagnosen er ligetil, hvis der er en historie med dyrebid, og hele spektret af symptomer og tegn er forekommet. Ellers er en omhyggelig, men hurtig evaluering af de epidemiologiske og kliniske træk ved mindre typiske tilfælde nødvendig, før der udføres specifikke laboratorietests. Enhver patient med neurologiske tegn eller symptomer eller uforklarlig encefalitis bør spørges om muligheden for eksponering for dyr i rabiesendemiske områder inden for eller uden for bopælslandet. Manglende mistanke om rabies i flere nylige menneskelige dødsfald i USA kan skyldes manglende omhyggelig eksponeringshistorik.
Ved sygdommens debut kan rabies efterligne mange infektiøse og ikke-infektiøse sygdomme. Mange andre encefalitter, såsom dem forårsaget af herpesvirus og arbovirus, ligner rabies. Andre infektionssygdomme kan også efterligne rabies, såsom stivkrampe, cerebral malaria, rickettsiose og tyfus. Paralytiske infektionssygdomme, der kan forveksles med rabies, omfatter polio, botulisme og herpes simian B-encefalitis.
Ikke-smitsomme sygdomme, der kan forveksles med rabies, omfatter en række neurologiske syndromer, især akut inflammatorisk polyneuropati (Guillain-Barré syndrom), samt allergisk encefalomyelitis efter vaccination sekundært til rabiesvaccination af nervevævet, forgiftning eller stofmisbrug, alkoholabstinenser, akut porfyri og rabieshysteri. Guillain-Barré syndrom kan forveksles med paralytisk rabies og omvendt.
Hvem skal kontakte?
Behandling Rabies
Behandling af rabies er ikke udviklet. Administration af store doser af specifikt anti-rabies immunoglobulin og leukocytinterferon er ineffektiv. Symptomatisk behandling gives for at lindre patientens lidelse. Til dette formål placeres patienten på en separat afdeling eller boks, og der oprettes et beskyttende regime, der begrænser påvirkningen fra det ydre miljø (reduceret støj, stærkt lys, luftgennemstrømning). For at reducere centralnervesystemets excitabilitet ordineres sovepiller, antikonvulsiva og smertestillende midler. Vandbalancen normaliseres.
I den lammende fase ordineres lægemidler, der stimulerer aktiviteten i det kardiovaskulære og respiratoriske system. Det anbefales at anvende hyperbarisk iltning, cerebral hypotermi, kontrolleret mekanisk vejrtrækning med fuldstændig kurarisering af patienten. Imidlertid er alle behandlingsmetoder praktisk talt ineffektive. I bedste fald er det muligt at forlænge patientens liv i flere måneder. Et ugunstigt resultat er forudbestemt af sværhedsgraden af skaden på hjernestammen med ødelæggelse af vitale centre.
Forebyggelse
Udviklingen af den første rabiesvaccine af Pasteur i 1885 indledte en æra med langt mere effektiv rabiesbekæmpelse. I dag, på trods af den næsten 100% dødelighed hos mennesker fra rabies, kan sygdommen fuldstændig forebygges gennem vaccination før og/eller efter eksponering. Mens Pasteur og hans kolleger startede vaccinationen af private hunde i Paris, blev den første massevaccination af hunde udført i begyndelsen af 1920'erne i Japan, hvilket markerede det første store nationale rabiesbekæmpelsesprogram. Oral vaccination af vilde dyr, der først blev udviklet i 1970'erne, har siden gentagne gange vist sig at kunne bekæmpe sygdommen effektivt hos større landlige værter såsom ræve, vaskebjørne og stinkdyr. [ 68 ] Vedvarende rabiesvaccination af reservoirdyrepopulationer med en dækningsgrad på 70% eller højere vil i sidste ende eliminere RABV fra reservoirarter og forhindre spredning af virussen til tilfældige værter. [ 69 ]
Fylogenetiske data indikerer, at lyssavirus inficerede flagermus længe før de inficerede landpattedyr, og de fleste lyssavirus, inklusive RABV, cirkulerer stadig i forskellige flagermusarter verden over.[ 70 ] Effektive metoder til at forhindre transmission af RABV blandt flagermus er dog stadig vanskelige at finde, hvilket udelukker muligheden for fuldstændig udryddelse af rabies på nuværende tidspunkt. Selv efter eksponering for RABV gennem bid fra et rabiesinficeret pattedyr kan sikker og effektiv posteksponeringsprofylakse (PEP, herunder sårrensning, rabiesimmunglobulin og rabiesvaccination) beskytte mennesker mod rabiesinfektion, hvis behandlingen administreres omgående og i overensstemmelse med Verdenssundhedsorganisationens (WHO) anbefalinger.
Disse to metoder til at forebygge menneskelige dødsfald – den ene baseret på vaccination af udsatte personer og den anden baseret på vaccination af nok hunde til at bryde smittespiralen ved kilden – er byggestenene i en "one health"-tilgang til forebyggelse og bekæmpelse af rabies hos hunde. Disse to forskellige metoder til at forebygge menneskelige dødsfald blev betragtet som separate alternativer: Strategi A, baseret på at give mennesker PEP, og Strategi B, baseret på vaccination af hunde; eller som komponenter i en kombineret strategi A + B i en analyse af de sandsynlige omkostninger ved de alternative strategier.[ 71 ]
Lande som Thailand har haft enorm succes med at forhindre menneskelige dødsfald ved brug af PEP, men har også oplevet en stigende efterspørgsel og tilhørende omkostninger forbundet med brugen af PEP alene. [ 72 ] For eksempel havde fire gange så mange mennesker (mere end 400.000) brug for PEP i 2003 sammenlignet med situationen i 1991. Nylige data viser, at Folkerepublikken Kina, som vaccinerer 15 millioner mennesker om året efter potentiel rabieseksponering, bruger omkring 650 millioner amerikanske dollars om året alene på PEP. [ 73 ]
En langt mere bæredygtig tilgang er at forhindre spredning af infektion ved kilden, i dyrepopulationen, samtidig med at adgangen til PEP øges for udsatte mennesker, når det er nødvendigt. Hvor der er politisk vilje og tilstrækkelig finansiering til at bekæmpe hunderabies, kan og er dødsfald blevet elimineret. Udbredt brug af hundevaccination har ført til udryddelse af hunderabies fra flere lande, herunder Malaysia i 1954, [ 74 ] Japan i 1956, Taiwan i 1961, Singapore og især i hele Vesteuropa (gennemgået i Rupprecht et al., King et al., og Gongal og Wright). [ 75 ]
Использованная литература


 [
[