Medicinsk ekspert af artiklen
Nye publikationer
Biskjoldbruskkirtler
Sidst revideret: 04.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
I 1879 beskrev den svenske videnskabsmand S. Sandström biskjoldkirtlerne hos mennesker og gav dem et navn. Biskjoldkirtlerne er vitale organer. Deres funktion er at producere og udskille biskjoldhormon (PTH), en af de vigtigste regulatorer af calcium- og fosformetabolisme.
Den parrede øvre biskjoldbruskkirtel (glandula parathyroidea superior) og nedre biskjoldbruskkirtel (glandula parathyroidea inferior) er runde eller ovale legemer placeret på bagsiden af hver af skjoldbruskkirtelens lapper: en kirtel øverst, den anden nederst. Længden af hver kirtel er 4-8 mm, bredden er 3-4 mm, tykkelsen er 2-3 mm. Antallet af disse kirtler er ikke konstant og kan variere fra 2 til 7-8, i gennemsnit er der fire. Kirtlernes samlede masse er i gennemsnit 1,18 g.
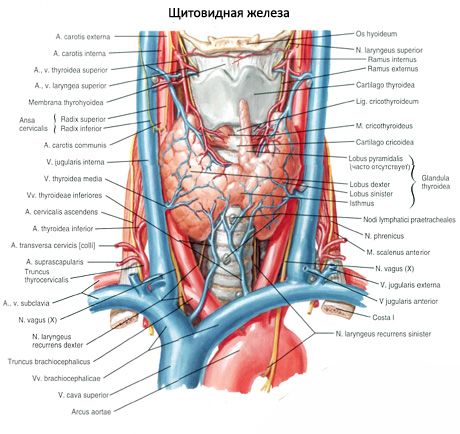
Biskjoldbruskkirtlerne adskiller sig fra skjoldbruskkirtlen ved deres lysere farve (hos børn er de lyserøde, hos voksne - gulbrune). Ofte er biskjoldbruskkirtlerne placeret på det sted, hvor skjoldbruskkirtelarterierne eller deres grene trænger ind i skjoldbruskkirtelvævet. Biskjoldbruskkirtlerne er adskilt fra det omgivende væv af deres egen fibrøse kapsel, hvorfra bindevævslagene strækker sig ind i kirtlerne. Sidstnævnte indeholder et stort antal blodkar og deler biskjoldbruskkirtlerne i grupper af epitelceller.
Kirtlernes parenkym dannes af de primære og acidofile parathyrocytter, som danner strenge og klynger omgivet af tynde bundter af bindevævsfibre. Begge celletyper betragtes som forskellige stadier af parathyrocytudviklingen. De primære parathyrocytter har en polyedrisk form, basofil cytoplasma med et stort antal ribosomer. Blandt disse celler skelnes mørke (aktivt secernerende) og lyse (mindre aktive). Acidofile parathyrocytter er store, med klare konturer, indeholder mange små mitokondrier med glykogenpartikler.
Biskjoldbruskkirtlernes hormon, parathyroxin (parathyroidhormon), har en proteinsammensætning og er involveret i reguleringen af fosfor-calciummetabolismen. Parathyroidhormon reducerer calciumudskillelsen i urinen og øger dets absorption i tarmen i nærvær af D-vitamin. Thyrocalcitonin er en antagonist af parathyroidhormon.
Embryogenese af biskjoldbruskkirtlerne
Biskjoldbruskkirtlerne udvikler sig fra epitelet i de parrede III og IV gællelommer. I den 7. udviklingsuge adskiller kroppens epitelrudimenter sig fra væggene i gællelommerne og bevæger sig under vækstprocessen i kaudal retning. Derefter indtager de dannende biskjoldbruskkirtler en permanent position for dem på de bageste overflader af skjoldbruskkirtelens højre og venstre lapper.
 [ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
[ 7 ], [ 8 ], [ 9 ], [ 10 ], [ 11 ], [ 12 ]
Kar og nerver i biskjoldbruskkirtlerne
Blodforsyningen til biskjoldbruskkirtlerne varetages af grene af de øvre og nedre skjoldbruskkirtelarterier, såvel som grenene af spiserøret og luftrøret. Venøst blod strømmer ud gennem venerne med samme navn. Innervationen af biskjoldbruskkirtlerne ligner innervationen af skjoldbruskkirtlen.
Aldersrelaterede træk ved biskjoldbruskkirtlerne
Den samlede masse af biskjoldbruskkirtlerne hos en nyfødt svinger mellem 6 og 9 mg. I løbet af det første leveår øges deres samlede masse 3-4 gange, ved 5-årsalderen fordobles den igen, og ved 10-årsalderen tredobles den. Efter 20 år når den samlede masse af de fire biskjoldbruskkirtler 120-140 mg og forbliver konstant indtil alderdommen. I alle aldre er massen af biskjoldbruskkirtlerne hos kvinder lidt større end hos mænd.
Normalt har en person to par biskjoldbruskkirtler (øvre og nedre), der er placeret på bagsiden af skjoldbruskkirtlen, uden for dens kapsel, nær de øvre og nedre poler. Antallet og lokaliseringen af biskjoldbruskkirtlerne kan dog variere; nogle gange findes der op til 12 biskjoldbruskkirtler. De kan være placeret i skjoldbruskkirtel- og thymusvævet, i det forreste og bageste mediastinum, i hjertesækken, bag spiserøret, i området for halspulsårens bifurkation. De øvre biskjoldbruskkirtler har form som en fladtrykt ægformet form, de nedre er sfæriske. Deres dimensioner er cirka fra 6x3 til 4x1,5 - 3 mm, den samlede vægt er fra 0,05 til 0,5 g, farven er rødlig eller gulbrun. Blodforsyningen til biskjoldbruskkirtlerne udføres hovedsageligt af grenene af den nedre skjoldbruskkirtelarterie, venøs udstrømning sker gennem venerne i skjoldbruskkirtlen, spiserøret og luftrøret. Biskjoldbruskkirtlerne er innerveret af sympatiske fibre fra de tilbagevendende og øvre larynxnerver, mens den parasympatiske innervation udføres af vagusnerverne. Biskjoldbruskkirtlerne er dækket af en tynd bindevævskapsel; de septa, der strækker sig fra den, trænger ind i kirtlerne. De indeholder blodkar og nervefibre. Biskjoldbruskkirtlernes parenkym består af parathyrocytter eller hovedceller, blandt hvilke der, afhængigt af farvningsgraden, skelnes hormonelt aktive lyse eller skinnende celler samt hvilende mørke celler. Hovedcellerne danner klynger, snore og klynger, og hos ældre - follikler med kolloid i hulrummet. Hos voksne optræder celler, der hovedsageligt er placeret langs periferien af biskjoldbruskkirtlerne, farvet med eosin - eosinofile eller oxyfile celler, som er degenererende hovedceller. I biskjoldbruskkirtlerne kan der også findes overgangsformer mellem hoved- og oxyfile celler.
De første succeser med at afklare synteseproblemer, afkode strukturen og studere parathyroidhormons metabolisme blev opnået efter 1972. Parathyroidhormon er et enkeltkædet polypeptid bestående af 84 aminosyrerester, uden cystein, med en molekylvægt på cirka 9500 dalton, dannet i biskjoldbruskkirtlerne fra en bioforløber - proparathyroidhormon (proPTH), som har 6 yderligere aminosyrer ved NH2- enden. ProPTH syntetiseres i biskjoldbruskkirtlernes hovedceller (i deres granulære endoplasmatiske reticulum) og omdannes til biskjoldbruskkirtelhormon i processen med proteolytisk spaltning i Golgi-apparatet. Dets biologiske aktivitet er betydeligt lavere end PTH's aktivitet. Tilsyneladende er proPTH fraværende i blodet hos raske mennesker, men under patologiske tilstande (med adenom i biskjoldbruskkirtlerne) kan det udskilles i blodet sammen med PTH. For nylig blev en forløber for proPTH, preproPTH, opdaget, som indeholder yderligere 25 aminosyrerester ved NH2-terminalen. Således indeholder præproPTH 115 aminosyrerester, proPTH - 90 og PTH - 84.
Strukturen af bovint og porcint parathyroidhormon er nu fuldt ud fastslået. Humant parathyroidhormon er blevet isoleret fra biskjoldbruskkirteladenomer, men dets struktur er kun delvist afkodet. Der er forskelle i strukturen af parathyroidhormon, men animalske og humane parathyroidhormoner udviser krydsimmunreaktivitet. Polypeptidet, der består af de første 34 aminosyrerester, bevarer praktisk talt den biologiske aktivitet af det naturlige hormon. Dette giver os mulighed for at antage, at de resterende næsten % af molekylet i carboxylenden ikke er direkte relateret til de primære virkninger af parathyroidhormon. Fragment 1-29 af parathyroidhormon udviser også en vis biologisk og immunologisk aktivitet. Biologisk inaktivt fragment 53-84 udviser også en immunologisk effekt, dvs. disse egenskaber ved parathyroidhormon udvises af mindst 2 sektioner af dets molekyle.
Det parathyroidhormon, der cirkulerer i blodet, er heterogent og adskiller sig fra det native hormon, der udskilles af biskjoldbruskkirtlerne. Mindst tre forskellige typer parathyroidhormon skelnes i blodet: intakt parathyroidhormon med en molekylvægt på 9.500 dalton; biologisk inaktive stoffer fra carboxyldelen af parathyroidhormonmolekylet med en molekylvægt på 7.000-7.500 dalton; biologisk aktive stoffer med en molekylvægt på omkring 4.000 dalton.
Endnu mindre fragmenter blev fundet i venøst blod, hvilket indikerer, at de blev dannet i periferien. De primære organer, hvor fragmenter af parathyreoideahormon blev dannet, var lever og nyrer. Fragmentering af parathyreoideahormon i disse organer var øget ved leverpatologi og kronisk nyresvigt (CRF). Under disse forhold forblev fragmenter af parathyreoideahormon i blodbanen betydeligt længere end hos raske individer. Leveren absorberede hovedsageligt intakt parathyreoideahormon, men fjernede hverken carboxylterminale eller aminoterminale parathyreoideahormonfragmenter fra blodet. Nyrerne spillede en ledende rolle i metabolismen af parathyreoideahormon. De tegnede sig for næsten 60 % af den metaboliske clearance af carboxylterminalt immunoreaktivt hormon og 45 % af det aminoterminale fragment af parathyreoideahormon. Hovedmetabolismen af det aktive aminoterminale fragment af parathyreoideahormon var knogler.
Pulserende sekretion af parathyroidhormon blev observeret, mest intens om natten. 3-4 timer efter nattens begyndelse er dets indhold i blodet 2,5-3 gange højere end det gennemsnitlige niveau om dagen.
Parathyroidhormonets hovedfunktion er at opretholde calciumhomeostase. Samtidig er serumcalcium (totalt og især ioniseret) den primære regulator af parathyroidhormonsekretion (et fald i calciumniveauet stimulerer parathyroidhormonsekretionen, mens en stigning undertrykker den), dvs. reguleringen udføres i henhold til feedbackprincippet. Under hypocalcæmi øges omdannelsen af proPTH til parathyroidhormon. Magnesiumindholdet i blodet spiller også en vigtig rolle i frigivelsen af parathyroidhormon (dets forhøjede niveau stimulerer, mens dets nedsatte niveau undertrykker parathyroidhormonsekretionen). Parathyroidhormonets primære mål er nyrerne og knoglerne, men parathyroidhormonets effekt på calciumabsorption i tarmen, kulhydrattolerance, serumlipidniveauer, dets rolle i udviklingen af impotens, hudkløe osv. er kendt.
For at karakterisere effekten af parathyroidhormon på knogler er det nødvendigt at give en kortfattet information om knoglevævets struktur, funktionerne i dets fysiologiske resorption og ombygning.
Det er kendt, at størstedelen af calcium i kroppen (op til 99%) findes i knoglevæv. Da det findes i knogler i form af fosfor-calciumforbindelser, findes % af det samlede fosforindhold også i knogler. Deres væv, på trods af sin tilsyneladende statiske natur, ombygges konstant, er aktivt vaskulariseret og har høje mekaniske egenskaber. Knoglevæv er et dynamisk "depot" af fosfor, magnesium og andre forbindelser, der er nødvendige for at opretholde homeostase i mineralmetabolismen. Dets struktur omfatter tætte mineralkomponenter, der er tæt forbundet med den organiske matrix, som består af 90-95% kollagen, små mængder mukopolysaccharider og ikke-kollagenproteiner. Den mineralske del af knoglen består af hydroxyapatit - dens empiriske formel er Ca10(PO4)6(OH)2 - og amorft calciumphosphat.
Knoglevæv dannes af osteoblaster, der stammer fra udifferentierede mesenkymceller. Disse er mononukleære celler, der er involveret i syntesen af komponenter i den organiske knoglematrix. De er placeret i et monolag på knogleoverfladen og er i tæt kontakt med osteoid. Osteoblaster er ansvarlige for aflejring af osteoid og dens efterfølgende mineralisering. Produktet af deres vitale aktivitet er alkalisk fosfatase, hvis indhold i blodet er en indirekte indikator for deres aktivitet. Omgivet af mineraliseret osteoid omdannes nogle osteoblaster til osteocytter - mononukleære celler, hvis cytoplasma danner kanaler forbundet med kanalerne i naboosteocytter. De deltager ikke i knogleombygning, men er involveret i processen med perilacunar destruktion, hvilket er vigtigt for den hurtige regulering af calciumniveauer i blodserum. Knogleresorption udføres af osteoklaster - kæmpe polynukleære celler, tilsyneladende dannet ved fusion af mononukleære makrofager. Det antages også, at forstadierne til osteoklaster kan være hæmatopoietiske stamceller i knoglemarven. De er mobile og danner et lag i kontakt med knoglen, placeret i områder med dens største resorption. På grund af frigivelsen af proteolytiske enzymer og syrefosfatase forårsager osteoklaster kollagennedbrydning, hydroxyapatitdestruktion og fjernelse af mineraler fra matrixen. Nydannet dårligt mineraliseret knoglevæv (osteoid) er resistent over for osteoklastisk resorption. Osteoblasternes og osteoklasternes funktioner er uafhængige, men koordinerede med hinanden, hvilket fører til normal skeletremodellering. Knoglevækst i længde afhænger af endokondral ossifikation, vækst i bredde og tykkelse - af periosteal ossifikation. Kliniske studier med 47 Ca har vist, at op til 18 % af det samlede calciumindhold i skelettet fornyes hvert år. Når knoglerne beskadiges (frakturer, infektiøse processer), resorberes den ændrede knogle, og der dannes ny knogle.
Cellekomplekser involveret i den lokale proces med knogleresorption og -dannelse kaldes basale multicellulære remodelleringsenheder (BMU'er). De regulerer den lokale koncentration af calcium, fosfor og andre ioner, syntesen af organiske komponenter i knogler, især kollagen, dets organisering og mineralisering.
Den primære effekt af parathyroidhormon i skelettets knogler er at forbedre resorptionsprocesserne, hvilket påvirker både mineralske og organiske komponenter i knoglestrukturen. Parathyroidhormon fremmer væksten af osteoklaster og deres aktivitet, hvilket ledsages af en forbedret osteolytisk effekt og en stigning i knogleresorptionen. I dette tilfælde opløses hydroxyapatitkrystaller med frigivelsen af calcium og fosfor i blodet. Denne proces er den primære mekanisme til at øge niveauet af calcium i blodet. Den består af tre komponenter: mobilisering af calcium fra den perilacunare knogle (dybe osteocytter); proliferation af osteoprogeneratorceller til osteoklaster; opretholdelse af et konstant niveau af calcium i blodet ved at regulere dets frigivelse fra knoglen (overfladiske osteocytter).
Således øger parathyroidhormon initialt aktiviteten af osteocytter og osteoklaster, hvilket forstærker osteolysen, hvilket forårsager en stigning i calciumniveauet i blodet og øget udskillelse af calcium og oxyprolin i urinen. Dette er den første, kvalitative, hurtige effekt af parathyroidhormon. Den anden effekt af parathyroidhormon på knoglerne er kvantitativ. Den er forbundet med en stigning i puljen af osteoklaster. Ved aktiv osteolyse forekommer en stimulus for øget proliferation af osteoblaster, både resorption og knogledannelse med en overvægt af resorption aktiveres. Ved et overskud af parathyroidhormon opstår en negativ knoglebalance. Dette ledsages af overdreven udskillelse af oxyprolin - et produkt af kollagennedbrydning og sialinsyrer, der er inkluderet i strukturen af mukopolysaccharider. Parathyroidhormon aktiverer cyklisk adenosinmonofosfat (cAMP). Øget udskillelse af cAMP i urinen efter administration af parathyroidhormon kan tjene som en indikator for vævsfølsomhed over for det.
Den vigtigste effekt af parathyroidhormon på nyrerne er dets evne til at reducere fosforreabsorption og dermed øge fosfaturien. Mekanismen for reduktion i forskellige dele af nefronet er forskellig: i den proximale del skyldes denne effekt af parathyroidhormon øget permeabilitet og forekommer med deltagelse af cAMP, mens den i den distale del ikke afhænger af cAMP. Den fosfaturiske effekt af parathyroidhormon ændrer sig med D-vitaminmangel, metabolisk acidose og nedsat fosforindhold. Parathyroidhormoner øger den samlede tubulære reabsorption af calcium en smule. Samtidig reducerer det den i de proximale dele og øger den i de distale dele. Sidstnævnte er af dominerende betydning - parathyroidhormon reducerer calciumclearance. Parathyroidhormon reducerer den tubulære reabsorption af natrium og dets bicarbonat, hvilket kan forklare udviklingen af acidose ved hyperparathyroidisme. Det øger dannelsen af 1,25-dioxycholecalciferol 1,25(OH2 ) D3 i nyrerne - den aktive form af vitamin D3. Denne forbindelse øger calciumreabsorptionen i tyndtarmen ved at stimulere aktiviteten af et specifikt calciumbindende protein (CaBP) i dens væg.
Det normale niveau af parathyroidhormon er i gennemsnit 0,15-0,6 ng/ml. Det varierer afhængigt af alder og køn. Det gennemsnitlige indhold af parathyroidhormon i blodet hos personer i alderen 20-29 år er (0,245±0,017) ng/ml, 80-89 år - (0,545±0,048) ng/ml; niveauet af parathyroidhormon hos 70-årige kvinder er (0,728±0,051) ng/ml, hos mænd i samme alder - (0,466±0,40) ng/ml. Således stiger indholdet af parathyroidhormon med alderen, men i større grad hos kvinder.
Som regel bør der anvendes flere forskellige tests til differentialdiagnosen af hypercalcæmi.
Vi præsenterer den kliniske og patogenetiske klassifikation, som vi har udviklet, baseret på klassifikationen af OV Nikolaev og VN Tarkaeva (1974).
Klinisk og patogenetisk klassificering af sygdomme forbundet med nedsat sekretion af parathyroidhormon og følsomhed over for det
Primær hyperparatyreoidisme
- Ved patogenese:
- hyperfunktionelle adenomer;
- hyperplasi af OGD;
- hyperfunktionel biskjoldbruskkirtelcarcinom;
- multipel endokrin neoplasi type I med hyperparatyreoidisme (Wermers syndrom);
- multipel endokrin neoplasi type II med hyperparatyreoidisme (Sipple syndrom).
- Ifølge kliniske træk:
- knogleform:
- osteoporotisk,
- fibrocystisk osteitis,
- "Pagetoid";
- visceropatisk form:
- med overvejende skade på nyrerne, mave-tarmkanalen, neuropsykiatrisk sfære;
- blandet form.
- knogleform:
- Nedstrøms:
- krydret;
- kronisk.
Sekundær hyperparathyroidisme (sekundær hyperfunktion og hyperplasi af biskjoldbruskkirtlerne med langvarig hypocalcæmi og hyperfosfatæmi)
- Nyrepatologi:
- kronisk nyresvigt;
- tubulopati (Albright-Fanconi-typen);
- nyre-rickets.
- Tarmpatologi:
- malabsorptionssyndrom.
- Knoglepatologi:
- senil osteomalaci;
- barselsdød;
- idiopatisk;
- Pagets sygdom.
- D-vitaminmangel:
- nyresygdom;
- lever;
- arvelige enzymmangler.
- Maligne sygdomme: myelomatose.
Tertiær hyperparathyroidisme
- Autonomt fungerende adenom(er) i biskjoldbruskkirtlerne, der udvikler sig på baggrund af langvarig sekundær hyperparatyreoidisme.
Pseudohyperparathyroidisme
- Produktion af parathyroidhormon af tumorer af ikke-parathyroidhormonisk oprindelse.
Hormonelt inaktive cystiske og tumorformationer af biskjoldbruskkirtlerne
- Cyste.
- Hormonelt inaktive tumorer eller karcinom.
Hypoparathyroidisme
- Medfødt underudvikling eller fravær af biskjoldbruskkirtlerne.
- Idiopatisk, autoimmun oprindelse.
- Postoperativ, udviklet i forbindelse med fjernelse af biskjoldbruskkirtlerne.
- Postoperativt på grund af nedsat blodforsyning og innervation.
- Strålingsskader, eksogene og endogene (ekstern strålebehandling, behandling af skjoldbruskkirtelsygdom med radioaktivt jod).
- Skade på biskjoldbruskkirtlerne på grund af blødning eller infarkt.
- Infektiøse læsioner.
Pseudohypoparathyroidisme
- Type I - målorganernes ufølsomhed over for parathyroidhormon, afhængig af adenylatcyklase;
- Type II - målorganernes ufølsomhed over for parathyroidhormon, uafhængigt af adenylatcyklase, muligvis af autoimmun oprindelse.
Pseudopseudohypoparathyroidisme
Tilstedeværelsen af somatiske tegn på pseudohypoparathyroidisme hos raske slægtninge i familier med patienter med pseudohypoparathyroidisme uden karakteristiske biokemiske lidelser og uden tetani.
 [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]

