Medicinsk ekspert af artiklen
Nye publikationer
Human immundefekt-virus (HIV)
Sidst revideret: 04.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Erhvervet immundefektsyndrom blev identificeret som en specifik sygdom i 1981 i USA, da en række unge mennesker udviklede alvorlige sygdomme forårsaget af mikroorganismer, der var ikke-patogene eller svagt patogene for raske mennesker. En undersøgelse af patienternes immunstatus afslørede et kraftigt fald i antallet af lymfocytter generelt og T-hjælpere i særdeleshed. Denne tilstand blev kaldt AIDS (Acquired Immune Deficiency Syndrome). Smittemetoden (seksuel kontakt, gennem blod og dets præparater) indikerede sygdommens infektiøse natur.
AIDS-udløsende agens blev opdaget i 1983 uafhængigt af franskmanden L. Montagnier, der kaldte det LAV Lymfoadenopati-associeret virus, da han fandt det hos en patient med lymfadenopati; og amerikaneren R. Gallo, der kaldte virussen HTLV-III (Human T-lymphotropisk virus III): han havde tidligere opdaget lymfotropiske vira I og II.
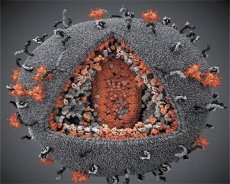
En sammenligning af egenskaberne ved LAV- og HTLV-III-virusserne viste deres identitet, så for at undgå forvirring blev virussen i 1986 navngivet HIV (Human Immunodeficiency Virus, eller HIV). HIV er sfærisk i form med en diameter på 110 nm. Virushylsteret har form som et polyeder, der består af 12 pentagoner og 20 sekskanter. I midten og hjørnerne af hver sekskant er der et molekyle af glycosyleret protein gpl20 (tallet 120 angiver proteinets molekylvægt i kilodalton). I alt 72 gpl20-molekyler er placeret på overfladen af virionet i form af særlige pigge, som hver især er forbundet med det intramembrane protein gp41. Disse proteiner danner sammen med det dobbelte lipidlag virionets superkapsidet (membran).
Proteinerne gpl20 og gp41 dannes ved at en cellulær protease skærer Env-forløberproteinet. Gp41-proteinet danner spids-"stilken" ved at binde med sit cytoplasmatiske domæne til matrixproteinet p17MA, der er placeret direkte under hylsteret. p17-molekylerne interagerer under virionsmodningen og danne et ikosaeder under hylsteret.
I den centrale del af virionet danner p24-proteinet en kegleformet kapsid. Den indsnævrede del af kapsidet er forbundet med virionmembranen med deltagelse af rb-proteinet. Inde i kapsidet er der to identiske molekyler af viralt genomisk RNA. De er forbundet med deres 5'-ender til nukleokapsidproteinet p7NC. Dette protein er interessant, fordi det har to aminosyrerester (motiver), der er rige på cystein og histidin og indeholder et Zn-atom - de kaldes "zinkfingre", fordi de indfanger molekyler af genomisk RNA til inklusion i de dannende virioner. Kapsidet indeholder også tre enzymer. Revertase (RT), eller pol-kompleks, omfatter revers transkriptase, RNase H og DNA-afhængig DNA-polymerase. Revertase er til stede som en heterodimer p66/p51. Protease (PR) - p10, initierer og implementerer processen med virionmodning. Integrase (IN) - p31, eller endonuklease, sikrer inklusionen af proviralt DNA i værtscellens genom. Kapsidet indeholder også et molekyle af primer-RNA (tRNAl"3).
RNA-genomet i cellen omdannes til et DNA-genom (DNA-provirus) ved hjælp af revers transkriptase, der består af 9283 nukleotidpar. Det er afgrænset til venstre og højre af såkaldte lange terminale gentagelser eller LTR'er: S'-LTR til venstre og 3'-LTR til højre. LTR'er indeholder hver 638 nukleotidpar.
HIV-genomet består af 9 gener, hvoraf nogle overlapper hinanden i enderne (har flere læserammer) og har en exonintronstruktur. De styrer syntesen af 9 strukturelle og 6 regulatoriske proteiner.
LTR'ernes betydning for det virale genom er, at de indeholder følgende regulatoriske elementer, der styrer dets funktion:
- transkriptionssignal (promotorregion);
- poly-A-additionssignal;
- afdækningssignal;
- integrationssignal;
- positivt reguleringssignal (TAR for TAT-protein);
- negativt regulatorisk element (NRE for NEF-protein);
- et sted for binding af primer-RNA (tRNA™3) til minus-strengs-DNA-syntese ved 3'-enden; et signal ved 5'-enden af LTR, der fungerer som en primer til plus-strengs-DNA-syntese.
Derudover indeholder LTR elementer involveret i reguleringen af mRNA-splejsning, pakning af vRNA-molekyler i kapsidet (Psi-element). Endelig dannes der under genomtranskriptionen to signaler i lange mRNA'er for REV-proteinet, som skifter proteinsyntese: CAR - for regulatoriske proteiner og CRS - for strukturelle proteiner. Hvis REV-proteinet binder til CAR, syntetiseres strukturelle proteiner; hvis det er fraværende, syntetiseres kun regulatoriske proteiner.
Følgende regulatoriske gener og deres proteiner spiller en særlig vigtig rolle i reguleringen af virusgenomets funktion:
- TAT-protein, som udfører positiv kontrol af viral replikation og virker gennem TAR-regulatorregionen;
- NEV- og VPU-proteiner, som udøver negativ kontrol over replikation gennem NRE-regionen;
- REV-protein, som udfører positiv-negativ kontrol. REV-proteinet styrer arbejdet i gag-, pol- og env-gener og udfører negativ regulering af splicing.
Således er HIV-replikation under tredobbelt kontrol - positiv, negativ og positiv-negativ.
VIF-proteinet bestemmer den nyligt syntetiserede viruss infektivitet. Det er associeret med p24-kapsidproteinet og er til stede i virionet i en mængde på 60 molekyler. NEF-proteinet er repræsenteret i virionet af et lille antal molekyler (5-10), muligvis associeret med membranen.
VPR-proteinet hæmmer cellecyklussen i G2-fasen, deltager i transporten af præintegrationskomplekser ind i cellekernen, aktiverer nogle virale og cellulære gener og øger effektiviteten af virusreplikation i monocytter og makrofager. Placeringen af VPR-, TAT-, REV- og VPU-proteinerne i virionet er ikke blevet fastslået.
Ud over sine egne proteiner kan virionmembranen indeholde nogle proteiner fra værtscellen. VPU- og VPR-proteiner deltager i reguleringen af viral reproduktion.
Antigene varianter af human immundefektvirus (HIV)
Human immundefektvirus (HIV) er meget variabel. Selv fra én patients krop kan virusstammer isoleres, der adskiller sig betydeligt i antigene egenskaber. En sådan variation fremmes af den intensive destruktion af CD4+ celler og et kraftigt antistofrespons på HIV-infektion. En ny form for HIV, HIV-2, der biologisk set er tæt på HIV-1, men immunologisk forskellig fra den, er blevet isoleret fra patienter fra Vestafrika. Homologien af den primære struktur af genomerne for disse vira er 42%. DNA-provirusset HIV-2 indeholder 9671 bp, og dets LTR - 854 bp. HIV-2 blev efterfølgende isoleret i andre regioner i verden. Der er ingen krydsimmunitet mellem HIV-1 og HIV-2. To store former for HIV-1 er kendt: O (Outlier) og M (Major), sidstnævnte er opdelt i 10 undertyper (AJ). Otte undertyper (AH) cirkulerer i Rusland.
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
Mekanismen for HIV's interaktion med cellen
Når virussen er trængt ind i kroppen, angriber den først celler, der indeholder den CD4-receptor, som er specifik for den. Denne receptor findes i store mængder i T-hjælpere, i mindre mængder i makrofager og monocytter, og T-hjælpere er særligt følsomme over for virussen.
Human immundefektvirus (HIV) genkender CD4-receptorer ved hjælp af sit gpl20-protein. HIV's interaktion med cellen sker i henhold til følgende skema: receptormedieret adsorption -> coated pit -> coated vesikel -> lysosom. I den smelter virionmembranen sammen med lysosommembranen, og nukleokapsidet, der er frigjort fra superkapsidet, trænger ind i cytoplasmaet; på vej til cellekernen ødelægges det, og genomisk RNA og tilhørende kernekomponenter frigives. Derefter syntetiserer revers transkriptase minus-DNA-strengen på virion-RNA'et, derefter ødelægger RNase H virion-RNA'et, og viral DNA-polymerase syntetiserer plus-DNA-strengen. 5'-LTR og 3'-LTR dannes i enderne af DNA-provirusset. DNA-provirusset kan forblive i cellekernen i nogen tid i en inaktiv form, men før eller siden integreres det i målcellens kromosom ved hjælp af dets integrase. I den forbliver provirusset inaktivt, indtil den givne T-lymfocyt aktiveres af mikrobielle antigener eller andre immunkompetente celler. Aktivering af cellulær DNA-transkription reguleres af en særlig nuklear faktor (NF-kB). Det er et DNA-bindende protein og produceres i store mængder under aktivering og proliferation af T-lymfocytter og monocytter. Dette protein binder sig til bestemte sekvenser af cellulært DNA og lignende LTR-sekvenser af DNA-provirusset og inducerer transkription af både cellulært DNA og DNA-provirusset. Ved at inducere transkription af DNA-provirusset udfører det overgangen af virusset fra en inaktiv tilstand til en aktiv og dermed fra en vedvarende infektion til en produktiv. Provirusset kan forblive i en inaktiv tilstand i meget lang tid. Aktivering af virusset er et kritisk øjeblik i dets interaktion med cellen.
Fra det øjeblik virussen trænger ind i cellen, begynder perioden med HIV-infektion - virusbærertilstanden, som kan vare 10 år eller mere; og fra det øjeblik virussen aktiveres, begynder sygdommen - AIDS. Ved hjælp af dens regulatoriske gener og deres produkter begynder virussen at reproducere sig aktivt. TAT-proteinet kan øge virusreproduktionshastigheden med 1000 gange. Viral transkription er kompleks. Den omfatter dannelsen af både fuldlængde og subgenomisk mRNA, mRNA-splejsning, og derefter forekommer syntesen af strukturelle og regulatoriske proteiner.
Syntesen af strukturelle proteiner sker som følger. Først syntetiseres Pr55Gag-forløberpolyproteinet (et protein med en molekylvægt på 55 kDa). Det indeholder 4 hoveddomæner: matrix (MA), kapsid (CA), nukleokapsid (NC) og rb-domænet, hvorfra de strukturelle proteiner p17, p24, p7 og rb dannes som følge af spaltning af Pr55Gag af viral protease (det spaltes selv fra et andet forløberprotein, Gag-Pol). Dannelsen af Pr55Gag-polyproteinet er hovedbetingelsen for dannelsen af virale partikler. Det er dette protein, der bestemmer virionets morfogeneseprogram. Det omfatter sekventielt transportfaserne af Gag-polyproteinet til plasmamembranen, interaktion med det og protein-protein-interaktioner under dannelsen af viralpartiklen og dens knopskydning. Pr55Gag syntetiseres på frie polyribosomer; proteinmolekyler transporteres til membranen, hvor de forankres af deres hydrofobe regioner. CA-domænet spiller hovedrollen i at skabe den native konformation af Gag-proteinet. NC-domænet sikrer inklusionen (ved hjælp af sine "zinkfingre") af 2 molekyler genomisk RNA i sammensætningen af den dannede viruspartikel. Polyproteinmolekylet dimeriserer initialt på grund af interaktionen mellem matrixdomænerne. Derefter kombineres dimererne til hexameriske (af 6 enheder) komplekser som et resultat af interaktionen mellem CA- og NC-domænerne. Endelig danner hexamererne, der forbindes på deres laterale overflader, umodne sfæriske virioner, indeni hvilke det genomiske virus-RNA er indeholdt, fanget af NC-domænet.
Et andet precursorprotein, Prl60Gag-Pol (et protein med en molekylvægt på 160 kDa), syntetiseres som følge af et frameshift af ribosomet under translation af 3'-enden af gag-genet i regionen, der er placeret umiddelbart opstrøms for den region, der koder for rb-proteinet. Dette Gag-Pol-polyprotein indeholder en ufuldstændig Gag-proteinsekvens (1-423 aminosyrer) og Pol-sekvenser, der inkluderer PR-, RT- og IN-domænerne. Gag-Pol-polyproteinmolekyler syntetiseres også på frie polyribosomer og transporteres til plasmamembranen. Prl60Gagpol-polyproteinet indeholder alle de intermolekylære interaktionssteder og membranbindingssteder, der er iboende i Gag-polyproteinet. Derfor fusionerer Gag-Pol-polyproteinmolekylerne med membranen og inkluderes sammen med Gag-molekylerne i de dannende virioner, hvilket resulterer i fremkomsten af aktiv protease og begyndelsen af virionmodningsprocessen. HIV-1-protease er kun yderst aktiv i form af en dimer, derfor er dimerisering af disse molekyler nødvendig for at kunne selv-ekscisionere dem fra Prl60Gag-Pol. Virionmodning består i, at den frigjorte aktive protease skærer prl60Gag-Pol og Gag55 på de steder, den genkender; proteinerne p17, p24, p7, p6, revertase og integrase dannes, og deres association i den virale struktur finder sted.
Env-proteinet syntetiseres på ribosomer forbundet med membranerne i det endoplasmatiske reticulum, hvorefter det glycosyleres, spaltes af en cellulær protease til gp120 og gp41 og transporteres til celleoverfladen. I dette tilfælde penetrerer gp41 membranen og binder sig til matrixdomænerne i Gag-proteinmolekylet forbundet med membranens indre overflade. Denne forbindelse bevares i det modne virion.
Således består samlingen af viruspartikler af aggregering af precursorproteiner og tilhørende RNA-molekyler på værtscellens plasmamembran, dannelsen af umodne virioner og deres frigivelse ved knopskydning fra celleoverfladen. Under knopskydningen omgiver virionet sig med en cellemembran, hvori gp41- og gp120-molekylerne er indlejret. Under knopskydningen eller muligvis efter frigivelsen af virioner finder deres modning sted, som udføres ved hjælp af en viral protease og består af proteolytisk spaltning af precursorproteinerne Pr55Gag og Prl60Gag-Pol i proteiner fra den modne virus og deres association til bestemte strukturelle komplekser. Den ledende rolle i processerne med viral morfogenese spilles af precursorpolyproteinet Pr55Gag, som organiserer og samler det umodne virion; processen med dets modning fuldføres af en specifik viral protease.
Årsager til immundefekt
En af hovedårsagerne til immundefekt ved HIV-infektion er massedød af T-hjælpere. Det sker som følge af følgende begivenheder. For det første dør T-hjælpere inficeret med virussen på grund af apoptose. Det menes, at hos AIDS-patienter er virusreplikation, apoptose og et fald i antallet af T-hjælpere forbundet. For det andet genkender og ødelægger T-dræbere T-celler inficeret med virussen eller bærer adsorberede gpl20-molekyler, såvel som virusinficerede og ikke-virusinficerede T-hjælpere, som danner symplaster (syncytium) bestående af flere dusin celler (nogle af dem dør som følge af reproduktion af vira i dem). Som følge af ødelæggelsen af et stort antal T-hjælpere er der et fald i ekspressionen af membranreceptorer i B-lymfocytter til interleukin-2, syntesen af forskellige interleukiner (vækstfaktorer og differentiering af B-lymfocytter - IL-4, IL-5, IL-6 osv.) forstyrres, hvilket resulterer i en forstyrrelse af T-dræbersystemets funktion. Aktiviteten af komplement- og makrofagsystemerne undertrykkes. Makrofager og monocytter inficeret med virus dør ikke i lang tid, men de er ikke i stand til at fjerne virusset fra kroppen. Endelig syntetiseres antireceptorantistoffer med et bredt virkningsspektrum på grund af den strukturelle og antigene lighed mellem gpl20 og receptorerne i nogle af kroppens epitelceller (herunder trofoblastreceptorer, der medierer transplantationstransmissionen af HIV). Sådanne antistoffer er i stand til at blokere forskellige cellulære receptorer og komplicere sygdomsforløbet med autoimmune sygdomme. Konsekvensen af HIV-infektion er nederlaget for alle de vigtigste led i immunsystemet. Sådanne patienter bliver forsvarsløse over for en bred vifte af mikroorganismer. Dette fører til udvikling af opportunistiske infektioner og tumorer. For patienter med HIV-infektion øges risikoen for at udvikle mindst tre typer kræft: Kaposis sarkom; karcinom (herunder hudkræft); B-celle lymfom, som opstår på grund af malign transformation af B-lymfocytter. HIV er dog ikke kun lymfocytotropisk, men også neurotropisk. Det trænger ind i cellerne i centralnervesystemet (astrocytter) både ved receptormedieret endocytose og ved fagocytose af virusinficerede lymfoblaster af astrocytter. Når virussen interagerer med astrocytter, dannes der også symplaster, som letter spredningen af patogenet gennem intercellulære kanaler. Virussen kan overleve i makrofager og monocytter i lang tid, så de fungerer som et reservoir og distributører af den i kroppen og er i stand til at trænge ind i alt væv. Inficerede makrofager spiller en vigtig rolle i introduktionen af HIV i centralnervesystemet og dets skade. Hos 10% af patienterne er primære kliniske syndromer forbundet med skade på centralnervesystemet og manifesterer sig som demens. Således er personer inficeret med HIV karakteriseret af 3 grupper af sygdomme - opportunistiske infektioner,tumorsygdomme og skader på centralnervesystemet.
Epidemiologi af HIV-infektion
Kilden til HIV-infektion er kun en person - en syg person eller en virusbærer. Human immundefektvirus (HIV) findes i blod, sædceller og livmoderhalsvæske; hos ammende mødre - i modermælk. Smitte sker seksuelt, gennem blod og dets præparater, samt fra mor til barn før, under og efter fødslen. Tilfælde af infektion med virussen gennem mad, drikkevarer og insektbid er ikke kendte.
Narkotikamisbrug bidrager til spredningen af AIDS. Forekomsten af HIV stiger hvert år. Ifølge WHO var 58 millioner mennesker smittet med HIV fra 1980 til 2000. Alene i 2000 var 5,3 millioner mennesker smittet på verdensplan, og 3 millioner mennesker døde af AIDS. Pr. 1. januar 2004 var der registreret 264 tusind HIV-smittede i Rusland. Halvdelen af de HIV-smittede dør inden for 11-12 år fra smitteøjeblikket. I begyndelsen af 2004 levede omkring 180 ud af hver 100 tusinde russiske borgere med en diagnose af "HIV-infektion". Det forudsiges, at med dette sygelighedsniveau vil det samlede antal HIV-smittede i Rusland i 2012 være 2,5-3 millioner mennesker. Kompleksiteten af kampen mod HIV-infektion afhænger af en række årsager: for det første er der ingen effektive metoder til behandling og specifik forebyggelse; for det andet kan inkubationsperioden for HIV-infektion overstige 10 år. Dens varighed afhænger af aktiveringsøjeblikket for T-lymfocytten og DNA-provirusset indeholdt i dens kromosom. Det er stadig uklart, om alle, der er inficeret med virussen, er dømt til AIDS, eller om langvarig bærerskab af virussen uden sygdom er mulig (hvilket synes usandsynligt). Endelig er der flere humane immundefektvira (HIV-1, HIV-2), hvis antigene forskelle forhindrer dannelsen af krydsimmunitet. Opdagelsen af simian immundefektvirus (SIV) kastede lys over spørgsmålet om HIV's oprindelse. SIV ligner HIV i sin genomorganisation, men adskiller sig betydeligt i sin nukleotidsekvens. HIV-2 indtager en mellemposition mellem HIV-1 og SIV i sine serologiske egenskaber og er tættere på SIV i sin nukleotidsekvens. I denne henseende foreslog V.M. Zhdanov, at HIV-1-, HIV-2- og SIV-vira stammer fra en fælles forfader. Ifølge R. Gallo er det muligt, at en af SIV'erne på en eller anden måde er kommet ind i menneskekroppen, hvor den gennemgik en række mutationer, hvilket resulterede i fremkomsten af HIV-1, HIV-2 og dens andre former.
Symptomer på HIV-infektion
Human immundefektvirus har nogle træk, der i høj grad bestemmer sygdommens patogenese. Virusset har en meget høj reproduktionsrate, bestemt af dets regulatoriske elementer (op til 5.000 virioner syntetiseres på 5 minutter i den aktive fase). På grund af tilstedeværelsen af fusionsproteinet (gp41) inducerer virussen dannelsen af omfattende syncytiale strukturer på grund af fusionen af inficerede og uinficerede T-hjælpere, hvilket resulterer i deres massedød. De gpl20-proteinmolekyler, der dannes i store mængder, cirkulerer frit i blodet og binder sig til receptorerne hos uinficerede T-hjælpere, hvorved de også genkendes og ødelægges af T-dræbere. Virussen kan spredes gennem intercellulære kanaler fra celle til celle, i hvilket tilfælde den bliver vanskeligt tilgængelig for antistoffer.
Kliniske kriterier for HIV-infektion
Hos voksne diagnosticeres HIV-infektion, når de har mindst to alvorlige symptomer i kombination med mindst ét mindre symptom og i fravær af andre kendte årsager til immundefekt (kræft, medfødt immundefekt, alvorlig sult osv.). Alvorlige symptomer omfatter:
- vægttab på 10% eller mere;
- en langvarig febertilstand, intermitterende eller konstant;
- kronisk diarré.
Mindre symptomer: vedvarende hoste, generaliseret dermatitis, tilbagevendende herpes zoster, oral og faryngeal candidiasis, kronisk herpes simplex, generaliseret lymfadenopati. Diagnosen AIDS stilles kun ved tilstedeværelse af Kaposis sarkom, kryptokokmeningitis, pneumocystis-pneumoni. Sygdommens kliniske billede påvirkes af den ledsagende opportunistiske infektion.
Metoder til dyrkning af human immundefektvirus (HIV)
HIV-1 og HIV-2 kan dyrkes i celler fra kun én klon af TCV4-lymfocytter - H9, udvundet fra leukæmiske TCV4-lymfocytter. Monolagskulturer af astrocytceller, hvor HIV-1 reproducerer sig godt, kan også anvendes til disse formål. Chimpanser er modtagelige for HIV-1 blandt dyr.
Virussens resistens i det ydre miljø er lav. Den dør under påvirkning af sollys og UV-stråling, ødelægges ved 80 °C inden for 30 minutter, og ved behandling med almindeligt anvendte desinfektionsmidler - inden for 20-30 minutter. For at desinficere virusholdigt materiale er det nødvendigt at bruge mykobakteriedræbende desinfektionsmidler, da de er effektive mod mikroorganismer med den højeste resistens.
Laboratoriediagnostik af HIV-infektion
Den primære metode til diagnosticering af virusbærer og HIV-infektion er enzymimmunoassay. Da gpl20 har strukturel og antigenlignende lighed med receptorer i nogle humane celler, herunder receptorer, der transporterer immunoglobuliner gennem epitelceller i slimhinderne, kan der imidlertid forekomme antistoffer relateret til antistoffer mod gpl20 i kroppen. I dette tilfælde kan der være falsk positive ELISA-resultater. Derfor gennemgår alle positivt reagerende sera fra forsøgspersonerne yderligere analyse ved hjælp af immunoblotting-metoden eller Western blotting. Denne metode er baseret på identifikation af de antistoffer, der undersøges, efter deres elektroforetiske separation og efterfølgende testning ved hjælp af mærkede anti-species-antistoffer. Den virologiske metode anvendes sjældent på grund af kompleksiteten ved dyrkning af virussen. H9-lymfocytklonen bruges til at opnå virale antigener - de nødvendige komponenter i diagnostiske testsystemer. CPR-metoden muliggør detektering af virussen i et tidligt stadium af viræmi.
Behandling af HIV-infektion
Det er nødvendigt at finde eller syntetisere lægemidler, der effektivt undertrykker aktiviteten af revers transkriptase (revertase) eller viral protease. De ville forhindre dannelsen af DNA-provirus og (eller) hæmme intracellulær reproduktion af virussen. Den moderne strategi til behandling af HIV-inficerede patienter er baseret på princippet om kombineret brug af lægemidler, der hæmmer viral protease (et af lægemidlerne) og reversease (2 forskellige lægemidler) - kombineret (tripel) terapi. I Rusland anbefales kombineret brug af 2 indenlandske lægemidler til behandling af HIV-inficerede patienter: phosphazid og crixivan, som specifikt undertrykker HIV-reproduktion i tidlige og sene stadier af reproduktionen, især med reduceret aktivitet af azidothymidin.
Problemet med specifik profylakse er behovet for at skabe en vaccine, der sikrer dannelsen af effektiv cellemedieret immunitet baseret på virusspecifikke cytotoksiske lymfocytter uden nogen signifikant produktion af antistoffer. En sådan immunitet tilvejebringes af Thl-hjælpere. Det er muligt, at antistoffer, herunder virusneutraliserende, ikke kun er ineffektive til at undertrykke HIV-infektion, men at de i høj grad undertrykker cellemedieret immunitet. Derfor skal en anti-HIV-vaccine først og fremmest opfylde to hovedkrav: a) være absolut sikker og b) stimulere aktiviteten af T-cytotoksiske lymfocytter. Effektiviteten af forskellige vaccinevarianter opnået fra dræbte (inaktiverede) vira og fra individuelle antigener med høje beskyttende egenskaber undersøges. Sådanne antigener kan enten isoleres fra selve virionerne eller syntetiseres kemisk. En vaccine skabt baseret på genteknologiske metoder er blevet foreslået. Det er en rekombinant vacciniavirus, der bærer HIV-gener, der er ansvarlige for syntesen af antigener med stærke immunogene egenskaber. Spørgsmålet om effektiviteten af disse vacciner kræver betydelig tid på grund af den lange inkubationsperiode for HIV-infektion og den høje variabilitet af patogenet. Oprettelsen af en yderst effektiv vaccine mod HIV er et presserende fundamentalt problem.

