Medicinsk ekspert af artiklen
Nye publikationer
Rollen af forandringer i subchondralbenet i patogenesen af slidgigt
Sidst revideret: 19.10.2021

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
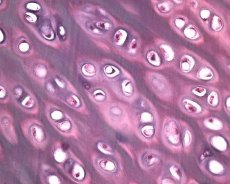
Sammen med degenerationen af ledbrusk involverer den patologiske proces i slidgigt det underliggende knoglevæv. Det foreslås, at fortykkelsen af subchondralpladen fremmer udviklingen af slidgigt. Som slidgigt udvikler sig artikulær brusk, som er en genstand for mekanisk og kemisk stress, langsomt eroderet på grund af en ubalance i katabolisme og brusk reparation. Især bidrager mekanisk stress i forhold til den "vægtbærende" kroppsmasse af leddene til dannelsen af et stort antal mikrofrakturer i subchondralpladen og brusk. Som leddbrusk eroderer, udvikler sklerose af subchondrale knogler stivheden af knoglevævet, hvilket igen bidrager til en yderligere forstyrrelse af ledbruskstruktur. Imidlertid forbliver spørgsmålet om den primære eller sekundære karakter af forandringer i subchondralbenet i osteoarthrose uopløst.
Indtil for nylig blev det antaget, at de radiografisk bestemte ændringer i den svampede substans af subchondralbenet, såsom sklerose eller cystedannelse hos patienter med slidgigt er sekundære. Resultaterne af kliniske og eksperimentelle undersøgelser indikerer imidlertid en mulig initierende rolle subchondralben i patogenesen af artrose. En mulig mekanisme er en kraftig stigning i stivhedsgradienten af subchondralbenet på grund af det faktum, at det korrekte bruskvævets integritet afhænger af de mekaniske egenskaber af sin knoglebed. Undersøgelser i primater har vist, at ændringer i subchondralbenet kan gå forud for ændringer i ledbrusk. Beviserne i modellerne af osteoarthrose hos dyr og kliniske undersøgelser af beviser til støtte for denne hypotese og imod det forværrede kun diskussionen. Tykning af trabekulae i subchondralbenet ledsages ikke altid af en stigning i mineralisering af knoglevæv, eller snarere en forøgelse af osteoidets volumen. Denne funktion anomale mineralisering antyder, at dysregulering af knogleremodellering er en integreret del af osteoarthritis, samt evidens for konceptet af defekt knogleceller i slidgigt. J. Dequeker-gruppen (1989) betragter sidstnævnte som en "generaliseret metabolisk knoglesygdom".
Knoglevæv opdateres løbende. Denne dynamiske proces, kaldet knoglemodellering, er en kompleks sekvens af processer med resorption og mineralisering. Osteoklaster resorb knoglevæv, og osteoblaster udskiller proteiner, der udgør den vigtigste organiske komponent til mineralisering. Uddannelse og knogleresorption tilfældigt stødt på skelettet, det er - en programmeret proces, der finder sted i forskellige dele af skelettet, kendt som knogle remodeling enheder. I begyndelsen af cyklussen vises osteoklaster på den inaktive overflade; Inden for 2 uger danner de en tunnel i det kortikale knogelag eller lacuna på overfladen af den trabekulære knogle. Frekvensen af aktivering af nye knoglemodelleringsenheder bestemmer graden af knoglevævsfornyelse. I en sund ung person er processerne for dannelse og resorption af knoglevæv afbalanceret, den normale masse af knoglevæv opretholdes. Den hormonale regulering af knogleresorption mindst PTH og PGE 2, deltog ikke kun af osteoklaster og osteoblaster, men som virkningen af disse hormoner, der frigives faktorer, der stimulerer knogleresorption af osteoklaster. I øjeblikket er der mere end 12 lokal og systemisk regulator af knoglevækst påvirker dens remodeling, navnlig PTH, 1,25 (OH) 2 D 3, calcitonin, væksthormon, glucocorticoider, thyroideahormoner, insulin, IGF (1 og 2), østrogener, PGE 2, androgener.
Knogleceller frigiver et antal proteiner og cytokiner, som udfører endokrin regulering og signaloverførsel. Proteiner produceret af osteoblaster indbefatter knoglematrixproteiner, såsom collagen, osteopontin, osteocalcin, knoglesialoproteiner. Derudover frigiver disse celler proteaser både i aktiv og latent form, som deltager i processen med knoglemodellering - MMP, komponenter i plasminogenaktivator (AP) / plasminaktivatorsystemet. De cytokiner frigivet af osteoblaster kan virke både gennem autokrine mekanismer og parakrine til lokale celler (andre osteoblaster, osteoklaster).
Det er endnu ikke kendt, hvorledes disse signaler reguleres - ved mekanisk belastning eller andre kemiske signaler fremkaldt af mekanisk stress. Det er imidlertid kendt, at gentagen mekanisk stress forårsager lokal proliferation af knogleceller ogleller proteiner. In vivo kan mekanisk stress aktivere osteoblaster, forøge cykliske nukleotidniveauer, producere prostaglandiner og forårsage også morfologiske forandringer forbundet med knoglemodellering. Under betingelser in vitro mekanisk belastning inducerer osteoblastproliferation kultur, mRNA-ekspression af knogle proteiner involveret i dannelsen af osteoid mineralisering og i processen, frigivelse af lokale vækstfaktorer, såsom IGF-1 og IGF-2, og adhæsionsmolekyler. Overførslen af et signal om mekanisk spænding kan opnås gennem mekanisk følsomme ionkanaler.
Der er indirekte tegn på nedsat osteoblastfunktion i slidgigt. G. Gevers og J. Dequeker (1987) har vist en stigning i serum osteocalcin hos kvinder med slidgigt i leddene i hænder, såvel som eksplantater af kortikal knogle, hvilket antyder, at patologien af knoglevævet kan være en del af slidgigt. Ved obduktion blev ikke kun fortykkelsen af subchondralbenet detekteret, men også den unormalt lave mineralisering af lårhovedet. I marsvin med kirurgisk induceret osteoarthritis afslørede computertomografi en signifikant fortykning af knoglefraktionen i subchondralzonen. Ubalancen mellem kollagen og ikke-kollagen (osteocalcin og andre) proteiner kan føre til en stigning i mængden af knoglevæv, men påvirker ikke dets mineraltæthed. Ifølge M. Shimizu et al (1993), progressionen af de degenerative ændringer i ledbrusken forbundet med mere intens remodellering af den subchondrale knogle og øge dens stivhed, hvilket også tyder på en defekt i knogleceller i slidgigt. Efter den foreslåede V. Lee og M. Aspden (1997) hypotese mangelfuld proliferation af knogleceller kan føre til en stigning i hårdhed af knogler, men ikke forårsager en stigning i BMD.
CI Westacott og medforfattere (1997) antydede, at unormale osteoblaster direkte påvirker metabolismen af bruskvæv. Dyrkning osteoblaster hos patienter med slidgigt chondrocytter med folk, der ikke har sygdomme i leddene, forfatterne observeret en betydelig ændring i frigivelsen af glucosaminoglycaner normal brusk væv in vitro, men niveauet af cytokinfrigørelse forblev uændret. G. Hilal et al (1998) viste, at kulturen af osteoblaster subchondral knogle af patienter med osteoarthritis in vitro har en ændret metabolisme - System Activity AP / plasmin og IGF-1 i disse celler forøges. Observationen af CI Westacott et al. (1997) kan forklares ved en forøgelse af proteaseaktivitet i subchondrale knogleceller.
Det er fortsat uvist, om slidgigt er indledt af ændringer i den subchondrale knogle og bidrage til dens progression? DK Dedrick et al (1993) viste, at hunde med kirurgisk induceret osteoarthritis subchondral knogle fortykkelse er ikke en forudsætning for udviklingen af osteoartrozpodobnyh ændringer i ledbrusk, men bidrager til progression af degenerative processer i brusken. Resultaterne af undersøgelsen A. Sa'ied et al (1997) er i modstrid med tidligere undersøgelser. Anvendelse ekkografi 50 MHz til evaluering af oprindelige morfologiske ændringer og deres progression i artikulær brusk og knogle i eksperimentelle slidgigt induceret monoyoduksusnoy sure injektioner i knæleddet af rotter, har vi vist samtidige procesændringer i knogle og brusk i de første tre dage efter injektionen.
Osteoblaster udskiller vækstfaktorer og cytokiner, der deltager i den lokale remodellering af knoglevæv, hvilket kan bidrage til omdannelse af bruskvæv i en passende "bærer vægt" leddene efter deres penetrering gennem mikrorevner i det forkalkede lag af brusk. Desuden findes produkterne fra knoglecellesekretion i synovialvæsken. De mest sandsynlige produkter secerneret unormale osteoblaster i stand til at køre lokale proces remodeling brusk er TGF-b og knoglemorfometriske proteiner (ILC). Begge repræsentanter for TGF-familien skelnes mellem chondrocytter og osteoblaster, og begge er i stand til at modificere remodelleringen af både knogle og bruskvæv. J. Martel Pelletier et al (1997) observerede en stigning i TGF-P-niveauer i den subchondrale knogle eksplantater osteoarthritis patienter sammenlignet med raske individer, hvilket indikerer en mulig rolle af denne vækstfaktor i patogenesen af osteoarthritis. IGF fremstilles også af osteoblaster. I kulturen af osteoblastlignende celler opnået fra patienter med slidgigt, er der konstateret en stigning i niveauet af IGF, som ændrer bruskets metabolisme.
TGF-b, IGF, Kommissionen og cytokinerne produceret af osteoblaster i den subchondrale knogle, kan påvirke produktionen af collagenase og andre proteolytiske enzymer i brusk, hvilket igen kan bidrage til remodeling / nedbrydning af brusk-matrix. Det er fortsat uklart, om osteoblaster producerer OA mindre makrofagkolonistimulerende faktor (M-CSF - en stimulator af knogleresorption) end normale celler. Forskningsresultater AG Uitterlinden og medarbejdere (1997) viste, at en rolle i dannelsen af osteofytter receptorer kan spille en D-vitamin, som udtrykkes af osteoblaster og regulere ekspressionen af flere faktorer syntetiseret af disse celler, hvilket til dels forklarer rolle osteoblaster i patogenesen af denne sygdom.
Betragtning af resultaterne af ovennævnte undersøgelser, G. Hilal et al (1998), J. Martel-Pelletier et al (1997) har foreslået følgende arbejdshypotese forhold remodeling subchondrale knogle og ledbrusk korrekt i slidgigt. På et tidligt eller forlænget stadium af OA-patogenese intensiveres processen med knoglevævsmodellering i subchondralbenet. Samtidigt gentagne belastning medfører lokale mikrofrakturer og / eller udseendet af systemets ubalance IGF / IGF-svyazyvayushy protein (IGFBP) på grund af en unormal reaktion af osteoblaster subchondral knogle, som fremmer dens sklerose. Sidstnævnte kan i sin tur bidrage til udseendet af mikrofrakturer af den korrekte brusk og beskadigelse af dens matrix.
Under normale betingelser elimineres denne skade ved lokal syntese og frigivelse af IGF-1 og IGF-bindende protein, som stimulerer dannelsen af ECM af ledbrusk. Samtidig fremmer PD-systemet væksten af subchondrale knogleceller og dannelsen af knoglematrix. Anabole aktivitet af IGF-systemet er steget subchondral knogle i slidgigtpatienter, hvorimod lokal aktivering SA-system / plasmin (lokal regulator af IGF-systemet) i ledbrusk forårsager dens lokale ændringer. I osteoblaster i slidgigt IGF-1 giver reguleringen af AP plasmin typen positiv feedback, kan derfor inhibere remodellering af knoglevæv, som i sidste ende fører til den subchondrale sklerose. Således i knogler og brusk lokal induktion af IGF-1 iproteaz fører, på den ene side, den skade på brusk, den anden - til en fortykkelse af den subchondrale knogle, sidstnævnte på sin side fremmer yderligere bruskskader. Ubalancen mellem brusk skader i forbindelse med subchondrale sklerose og dens reparationskapacitet, fører til progressive ændringer i brusken ECM og for udviklingen af slidgigt. Ifølge forfatterne forklarer denne hypotese også den langsomme udvikling af sygdommen.

