Medicinsk ekspert af artiklen
Nye publikationer
Den humane immundefektvirus (HIV)
Sidst revideret: 23.04.2024

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Erhvervet immundefektsyndrom blev identificeret som en bestemt sygdom i 1981 i USA, hvor et antal unge har alvorlige sygdomme forårsaget af mikroorganismer, ikke-patogene eller lave patogen for raske personer. Undersøgelse af patienters immunforsvar afslørede et kraftigt fald i antallet af lymfocytter generelt og især T-hjælpere. Denne betingelse hedder aids (engelsk erhvervet immundefekt syndrom - erhvervet immundefekt syndrom eller aids). Infektionsmetode (seksuel kontakt via blod og blodprodukter) indikerede infektiøse af sygdommen.
AIDS-årsagsmidlet blev opdaget i 1983 uafhængigt af franskmanden L. Montagnier, der kaldte ham LAV-lymfoadenopati associeret virus), da han opdagede en patient med lymfadenopati; og den amerikanske R. Gallo, der kaldte viruset HTLV-III (engelsk human T-lymfotropisk virus III): tidligere blev han fundet lymfotropiske vira I og II.
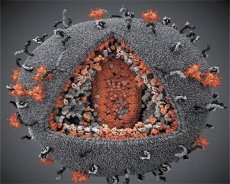
Sammenligning af egenskaberne af LAV- og HTLV-III-vira viste deres identitet, derfor blev viruset i 1986 kaldet HIV (Human Immunodeficiency Virus eller HIV) for at undgå forvirring. HIV er sfærisk, dens diameter er 110 nm. Virusets kuvert har form af en polyhedron bestående af 12 pentagoner og 20 hexagoner. Molekylet af det glycosylerede protein gpl20 er placeret i midten og hjørnerne af hver sekskant (tallet 120 betyder molekylvægten af proteinet i kilodaltoner). I alt 72 gpl20 molekyler er placeret på overfladen af virionen, som hver især er forbundet med intramembranproteinet gp41. Disse proteiner sammen med dobbelt lipidlaget danner virionens superkapsel (membran).
Proteinerne gpl20 og gp41 dannes som et resultat af celleproteaseskæring af precursorproteinet Env. Protein gp41 danner "studen" af rygsøjlen, der er bundet af det cytoplasmatiske domæne med matrixproteinet p17MA umiddelbart under membranen. Molekyler p17, som interagerer med modningen af virionen, danner en icosahedron, der ligger bag skallen.
I den centrale del af virionen danner p24-proteinet et konisk kapsid. Den indsnævrede del af kapsidet med deltagelse af pb-proteinet er forbundet med virionens kuvert. Inden for kapsidet er der to identiske molekyler af viralt genomisk RNA. De er bundet ved deres 5'-ender til nucleocapsidproteinet p7NC. Dette protein er interessant, fordi den har to aminosyrerester (motiv), cystein-rige og histidin atom og indeholdende Zn, - de kaldes "zinkfinger", som de fange molekylet af genomisk RNA til inkorporering i virions dannes. Kapsidet indeholder også tre enzymer. Reversase (RT), eller pol-kompleks, indbefatter revers transkriptase, RNA-ase H og DNA-afhængig DNA-polymerase. Revertasen er til stede som en p66 / p51 heterodimer. Protease (PR) - pI starter og realiserer processen med virion modning. Integration (IN) - p31 eller endonuclease sikrer inddragelse af proviralt DNA i genomet af værtscellen. Capsidet indeholder også et frø-RNA-molekyle (tRNA1 "3).
RNA-genet i cellen omdannes ved revers transkriptase til et DNA-genom (DNA-provirus) bestående af 9283 nukleotidpar. Det er begrænset til venstre og højre ved de såkaldte langende gentagelser eller LTR (engelsk lang terminal gentagelse): S'-LTR - venstre og Z'-LTR - til højre. LTR indeholder 638 nukleotidpar.
HIV-genomet består af 9 gener, hvoraf nogle er overlappede (har flere læserammer) og har en exoninstruktur. De styrer syntesen af 9 strukturelle og 6 regulatoriske proteiner.
LTR-værdien for virusgenomet er, at de indeholder følgende regulatoriske elementer, der styrer dets funktion:
- transkriptionssignal (promotorregion);
- signalet for tilsætning af poly-A;
- Capture signal;
- signalintegration;
- et positivt reguleringssignal (TAR for TAT-protein);
- element af negativ regulering (NRE for NEF protein);
- fastgørelsesstedet for frø-RNA'et (tRNA ™ 3) til syntese af minuskæden af DNA ved 3'-enden; signal ved 5'-enden af LTR'en, som tjener som en primer til syntese af plusstrengen af DNA.
Derudover indeholder LTR elementer involveret i reguleringen af mRNA-splejsning, pakning af vRNA-molekylerne i capsidet (Psi-elementet). Endelig genereres der ved signering af genomet i lange mRNA'er to signaler for REV-proteinet, som ændrer proteinsyntese: CAR for regulatoriske proteiner og CRS for strukturelle proteiner. Hvis REV protein binder til CAR, syntetiseres strukturelle proteiner; Hvis det er fraværende, syntetiseres kun regulerende proteiner.
Ved reguleringen af genomets virus spiller de følgende regulerende gener og deres proteiner en særlig vigtig rolle:
- et TAT-protein, der udfører en positiv kontrol af reproduktionen af viruset og virker gennem et regulatorisk TAR-sted
- proteiner NEV og VPU, der udfører negativ kontrol af reproduktion gennem NRE-stedet;
- protein REV, der udfører en positiv-negativ kontrol. Protein REV kontrollerer genernes arbejde gag, pol, env og udfører en negativ regulering af splejsning.
Således er reproduktionen af HIV under en tredobbelt kontrol - positiv, negativ og positiv-negativ.
VIF-proteinet bestemmer infektiviteten af den nyligt syntetiserede virus. Det er bundet til capsidproteinet p24 og er til stede i virionen i en mængde på 60 molekyler. NEF-proteinet er repræsenteret i virionen af et lille antal molekyler (5-10), eventuelt forbundet med konvolutten.
VPR-protein hæmmer cellecyklussen i G2-fase, deltager i transporten af præintegrationskomplekser ind i kernen i cellen, aktiverer nogle virale og cellulære gener, øger effektiviteten af viral replikation i monocytter og makrofager. Placeringen af proteiner VPR, TAT, REV, VPU i virionen er ikke etableret.
Ud over sine egne proteiner kan sammensætningen af virionsmembranen omfatte nogle proteiner fra værtscellen. Proteiner VPU og VPR er involveret i regulering af virusreproduktion.
Antigeniske varianter af human immunodeficiency virus (HIV)
Den humane immundefektvirus (HIV) er meget variabel. Selv fra organismen af en patient kan virusstammer, der adskiller sig væsentligt i antigeniske egenskaber, isoleres. En sådan variabilitet fremmes ved intensiv ødelæggelse af CD4 + -celler og et kraftigt antistofrespons til HIV-infektion. Patienter fra Vestafrika har en ny form for hiv, biologisk tæt på HIV-1, men immunologisk forskellig fra HIV-2. Homologien af den primære struktur af genomerne af disse vira er 42%. DNA-provirus HIV-2 indeholder 9671 bp og dets LTR-854 bp. HIV-2 blev efterfølgende isoleret i andre regioner i verden. Der er ingen krydsimmunitet mellem HIV-1 og HIV-2. To store former for HIV-1 er kendt: O (Outlier) og M (Major), sidstnævnte er opdelt i 10 subtyper (AJ). I Rusland cirkulerer 8 undertyper (AH).
Mekanismen for interaktion mellem HIV og cellen
Efter at have trængt ind i kroppen angriber viruset først celler indeholdende en specifik CD4-receptor. Denne receptor har et stort antal T-hjælpere, i mindre - makrofager og monocytter, især de virusfølsomme T-hjælpere.
Det humane immunbristvirus (HIV) genkender CD4-receptorer med dets gpl20-protein. Processen med interaktion af HIV med cellen fortsætter i overensstemmelse med følgende skema: receptor-medieret adsorption -> grænset fovea -> grænset vesikel -> lysosom. I den fusionerer virionsmembranen sammen med lysosommembranen, og nukleocapsidet frigjort fra supercapsidet trænger ind i cytoplasmaet; På vej til kernen er det ødelagt, og genomisk RNA og tilhørende kernekomponenter frigives. Så syntetiserer den omvendte transkriptase DNA-minuskæden på virion-RNA'et, så ødelægger RNA-as H virion-RNA'et, og viral-DNA-polymerasen syntetiserer plusstrengen af DNA'et. Ved enderne af DNA-proviruset dannes 5'-LTR og 3'-LTR. DNA-provirus kan være i kernen i et stykke tid i en inaktiv form, men før eller senere integreres den med hjælp af dens integrase ind i målcelleets kromosom. I det er proviruset i inaktiv tilstand, indtil denne T-lymfocyt aktiveres af mikrobielle antigener eller andre immunokompetente celler. Aktivering af transkription af cellulært DNA reguleres af en særlig nuklear faktor (NF-kB). Det er et DNA-bindende protein og produceres i store mængder under aktiveringen og proliferationen af T-lymfocytter og monocytter. Dette protein binder til specifikke sekvenser af cellulært DNA og lignende sekvenser af LTR DNA-provirus og inducerer transkription af både cellulært DNA og DNA-provirus. Ved at fremkalde transkription af DNA-proviruset overfører han virussen fra en inaktiv tilstand til en aktiv og følgelig en vedvarende infektion til en produktiv. Ophold provirus i inaktiv tilstand kan vare meget lang tid. Aktivering af virussen er et kritisk øjeblik i samspillet med cellen.
Fra det øjeblik viruset kommer ind i cellen, begynder en periode med hiv-infektion, en virus, der kan vare 10 år eller mere; og siden aktiveringen af virusen begynder sygdommen - aids. Ved hjælp af deres regulerende gener og deres produkter begynder viruset at formere sig aktivt. TAT-protein kan øge reproduktionshastigheden af virussen 1000 gange. Transkription af virus er kompleks. Det omfatter dannelsen af både fuld længde og subgenomiske mRNA'er, splejsning af mRNA og yderligere syntese af strukturelle og regulatoriske proteiner.
Syntese af strukturelle proteiner forekommer som følger. For det første syntetiseres polyproteinprecursoren Pr55Gag (protein med en masse på 55 kD). Den indeholder fire hovedområder: en matrix (MA), capsid (CA), nucleocapsid (NC) og domæne pe, hvoraf resulterer skæring Pr55gag viral protease (det samovyrezaetsya fra et andet protein precursor - Gag-Pol) er udformet henholdsvis strukturelle proteiner p17 , p24, p7 og pb. Dannelsen af polyproteinet Pr55Gag er den vigtigste betingelse for dannelsen af virale partikler. Det er dette protein, der bestemmer programmet for morfogenese af virionen. Det omfatter trinnene sekventielt Gag polyprotein transport til plasmamembranen og dets interaktion med protein-protein-interaktioner i dannelsen af viruspartikel og dens knopskydning. Pr55Gag syntetiseres på frie polyribosomer; Proteinmolekylerne transporteres til membranen, hvorpå de forankrer sig med deres hydrofobe pletter. Hovedrollen i at skabe en indfødt konformation af Gag-proteinet spilles af CA-domænet. NC-domæne switch (ved hjælp af de "zinkfingre") 2-molekyle af genomisk RNA i det virale partikeldannende. Polyproteinmolekylet dimeriseres først på grund af interaktionen mellem matrixdomeiner. Dimerne kombineres derefter til hexameriske (fra 6 enheder) komplekser som et resultat af interaktionen mellem CA og NC domænerne. Endelig hexamerer, udgør forbindende sideflader umodne virioner sfærisk form, inden i hvilken indeholder viralt genomisk RNA fanget NC-domæne.
En anden precursorproteinet Prl60Gag-Pol (proteinet med m. M. 160 kDa) syntetiseres som et resultat af forskydning af læserammen af ribosomet under translation Z'-terminalen af gag-genet ind i et område umiddelbart før kodende region RB-protein. Dette Gag-Pol polyprotein indeholder en ufuldstændig sekvens af Gag protein (1 - 423 aminosyrer) og Pol sekvenser, som indbefatter PR, RT og IN domæner. Molekylerne af polyproteinet Gag-Pol syntetiseres også på frie polyribosomer og transporteres til plasmamembranen. Polyproteinet Prl60Gagpol indeholder alle de steder af intermolekylære interaktioner der er iboende i polyprotein Gag og membranbindingssteder. Derfor molekylerne af polyproteinet Gag-Pol sikring med membranen og sammen med Gag-molekyler indbefatter danner virioner, der kan resultere i en aktiv protease og virion modningsprocessen begynder. HIV-1 Protease meget aktiv kun som en dimer, så det samovyrezaniya af Prl60Gag-Pol kræver dimerisering af disse molekyler. Modning af virionen er, at den frigivne aktive protease skærer prl60Gag-Pol og Gag55 til genkendelige steder; Proteiner p17, p24, p7, p6, revertase, integrase dannes, og deres association i den virale struktur finder sted.
Env-proteinet syntetiseres på ribosomer bundet til membraner i det endoplasmatiske retikulum, hvorefter det glycosyleres, skæres af den cellulære protease på gp120 og gp41 og transporteres til celleoverfladen. I dette tilfælde gennemsyrer gp41 membranen og binder til matrixdomeinerne af Gag-proteinmolekylet associeret med den indre overflade af membranen. Dette forhold fortsætter i den modne virion.
Således, samling af viruspartikler er aggregering af precursorproteiner og beslægtede RNA-molekyler på plasmamembranen af værtscellen, dannelse af umodne virioner og deres frigivelse ved knopskydning fra celleoverfladen. Når spirende omgiver sig med en cellemembran, hvor gp41 og gp120 molekyler er indlejret. Under knopskydning eller eventuelt efter frigivelse af virion modning forekommer, som udføres ved anvendelse af en viral protease proteolytisk skæring Pr55gag precursorproteiner og Prl60Gag-Pol virus til modne proteiner og deres tilknytning til specifikke strukturelle komplekser. En ledende rolle i morfogenese af viruset spiller en polyprotein-precursor Pr55gag, som organiserer og samler umodne virion; Processen med dens modning afsluttes af en specifik viral protease.
Årsager til immundefekt
En af hovedårsagerne til immundefekt ved HIV-infektion er T-helpers massedød. Det opstår på grund af følgende begivenheder. For det første dør T-hjælpervirus inficeret af virussen på grund af apoptose. Det antages, at hos AIDS-patienter er viral replikation, apoptose og et fald i antallet af T-hjælpere relateret. For det andet T-dræberceller genkender og ødelægger T-celler inficeret med en virus eller bærer det adsorberede gpl20 molekylet, samt virusinficerede og virusinficerede T-hjælperceller, som danner symplasts (syncytia) bestående af flere snese af celler (del af en de dør som følge af multiplikationen af vira i dem). Som følge af ødelæggelse af et stort antal af T-hjælper celler forekommer fald membran receptorekspression i B-lymfocytter til IL-2, forstyrret syntese af forskellige interleukiner (vækstfaktorer og differentiering af B-lymfocytter -. IL-4, IL-5, IL-6, og andre) som følge heraf overtræder funktionen af T-killersystemet. Suppression af aktiviteten af komplement og makrofagesystemer forekommer. Virus-inficerede makrofager og monocytter lang tid at dø, men de er ikke i stand til at fjerne virus fra kroppen. Endelig, på grund af de strukturelle og antigene ligheder med receptorer gpl20 nogle epitelceller af organismen (herunder trofoblaster receptorkoblede medierer overførsel af HIV transplantation) syntetiseres antiretseptornyh antistoffer med et bredt virkningsspektrum. Sådanne antistoffer kan blokere forskellige cellulære receptorer og komplicere sygdommens forløb med autoimmune sygdomme. Konsekvensen af hiv-infektion er nederlaget for alle væsentlige dele af immunsystemet. Sådanne patienter bliver forsvarsløse mod en lang række mikroorganismer. Dette fører til udvikling af opportunistiske infektioner og neoplastiske sygdomme. Hos patienter med HIV-infektion har mindst tre typer kræft været i øget risiko: Kaposi sarkom; carcinomer (herunder hudkræft); B-celle lymfom som følge af malign degeneration af B-lymfocytter. Hiv har imidlertid ikke kun lymfocyt, men også neurotropisk. Det trænger i CNS-celler (astrocytter) enten ved receptormedieret endocytose og fagocytose af astrocytter med virusinficerede lymfoblaster. I interaktionen af viruset med astrocytterne dannes også symplasts befordrende for spredning af patogenet intercellulære kanaler. I makrofager og monocytter kan virusset vare ved i lang tid, så de tjener som et reservoir og dets distributører i kroppen, at kunne trænge ind i alle væv. Inficerede makrofager spiller en vigtig rolle i migrering af HIV i centralnervesystemet og dets nederlag. Hos 10% af patienterne er primære kliniske syndrom forbundet med CNS-skade og manifesterer sig som demens (demens). Således for personer ramt af HIV infektion er kendetegnet ved 3 grupper af sygdomme - opportunistiske infektioner, tumorsygdomme og CNS.
Epidemiologi af HIV-infektion
Kilden til hiv-infektion er kun en person - en syg eller en virusbærer. Den humane immundefektvirus (HIV) findes i blodet, sæden, cervikalvæsken; hos ammende mødre - i modermælk. Infektion forekommer seksuelt, gennem blodet og dets stoffer, såvel som fra moder til barn før fødslen, under og efter fødslen. Tilfælde af virusinfektion gennem mad, drikkevarer og gennem insektbid er ikke kendt.
Narkotikamisbrug bidrager til spredning af aids. HIV-infektion stiger hvert år. Ifølge WHO, fra 1980 til 2000, var 58 millioner mennesker smittet med hiv. Kun i 2000 blev 5,3 millioner mennesker smittet i verden, og 3 millioner mennesker døde af aids. I Rusland var der fra 1. Januar 2004 264.000 hiv-positive personer registreret. Halvdelen af dem, der er smittet med hiv, dør inden for 11-12 års infektion. I begyndelsen af 2004 levede omkring 180 af hver 100.000 russiske statsborgere med diagnosen "HIV-infektion". Det forventes, at det samlede antal HIV-inficerede mennesker i Rusland inden 2012 vil være 2,5-3 millioner mennesker. Kompleksiteten i kampen mod hiv-infektion afhænger af en række grunde: For det første findes der ingen effektive metoder til behandling og specifik forebyggelse; For det andet kan inkubationsperioden for HIV-infektion overstige 10 år. Dens varighed afhænger af tidspunktet for aktivering af T-lymfocyten og DNA-proviruset indeholdt i dets kromosom. Det er endnu ikke klart, om hver virus inficeret med aids er dømt eller sandsynligvis vil have en langvarig virus uden sygdom (hvilket forekommer usandsynligt). Endelig er der adskillige humane immundefektvirus (HIV-1, HIV-2), antigene forskelle mellem hvilke forhindrer dannelsen af krydsimmunitet. Påvisning af immunbristvirus af aber (SIV) skildrer hiv-oprindelsen. SIO'en til at organisere genomet ligner hiv, men den adskiller sig væsentligt i nukleotidsekvensen. HIV-2 indtager serologisk en mellemliggende position mellem HIV-1 og SIV, og nukleotidsekvensen var tættere på SIV. I den forbindelse foreslog VM Zhdanov, at viruserne HIV-1, HIV-2 og SIV stammede fra en fælles forfader. Det er muligt, ifølge R. Gallo, at en af SIV'erne på en eller anden måde kom ind i menneskekroppen, hvor han gennemgik en række mutationer, hvilket resulterede i HIV-1, HIV-2 og andre former for det.
Symptomer på hiv-infektion
Viruset af humant immundefekt karakteriseres af visse træk, hvor sygdomspatogenesen i høj grad afhænger. Virusen har en meget høj reproduktionshastighed, bestemt af dets regulatoriske elementer (5.000 virioner syntetiseres inden for 5 minutter i det aktive trin). På grund af tilstedeværelsen af fusionsproteinet (gp41) virus inducerer dannelsen af store syncytial strukturer ved at fusionere både inficerede og ikke-inficerede T-hjælperceller, hvilket resulterer i deres masse død. Gpl20-molekyler med stort molekyle cirkulerer frit i blodet og binder til receptorer af uinficerede T-hjælpere, som følge heraf de også genkendes og ødelægges af T-killere. Virusen kan sprede sig gennem de intercellulære kanaler fra cellen til cellen, i dette tilfælde bliver den mindre tilgængelig for antistofferne.
Kliniske kriterier for HIV-infektion
Voksen HIV fastslå, om de har mindst to alvorlige symptomer i kombination med mindst ét symptom på en mindre i fravær af andre kendte årsager til immundefekt (kræft, medfødt immundefekt, svær sult, og så videre. P.). Alvorlige symptomer omfatter:
- vægttab med 10% eller mere
- langvarig feber, intermitterende eller vedholdende
- kronisk diarré.
Mindre symptomer omfatter vedvarende hoste, generaliseret dermatitis, tilbagevendende herpes zoster, candidiasis i mundhulen og svælg, kronisk herpes simplex, generaliseret lymfadenopati. Diagnosen af AIDS er lavet med tilstedeværelsen af kun Kaposi sarkom, kryptokokhindebetændelse, pneumocystis lungebetændelse. Det kliniske billede af sygdommen påvirkes af en opportunistisk infektion.
Metoder til dyrkning af human immunodeficiency virus (HIV)
HIV-1 og HIV-2 kan dyrkes i cellerne af kun en klon af TCB4-lymfocytter - H9, opnået fra leukæmiske TCV4-lymfocytter. Monolagskulturer af astrocytceller kan også anvendes til disse formål, hvor HIV-1 multiplicerer godt. Fra dyr til hiv-1 modtagelige chimpanser.
Virusets modstand i det ydre miljø er lavt. Han dør under påvirkning af sollys og UV-bestråling, ødelægges ved 80 ° C i 30 minutter, når det behandles med almindeligt anvendte desinfektionsmidler - i 20-30 minutter. For at desinficere det virusholdige materiale er det nødvendigt at anvende mycobactericid desinfektionsmidler, da de er effektive mod mikroorganismer med den højeste resistens.
Laboratoriediagnose af HIV-infektion
Den vigtigste måde at diagnosticere virus- og hiv-infektion på er enzymimmunoassayet. Men på grund af det faktum, at gpl20 har strukturel og antigene lighed med receptorer af visse humane celler, herunder receptorer der udfører transport af immunoglobuliner gennem epithelceller af slimhinder i kroppen kan vises antistoffer relaterede antistoffer mod gpl20. I dette tilfælde kan der være falske positive resultater af IFM. Derfor underkastes alle positivt reagerende sera fra de undersøgte yderligere analyse ved hjælp af immunoblot-metoden eller western blotting. Denne metode er baseret på identifikationen af antistofferne, der skal studeres efter elektroforetisk separation og efterfølgende test med mærkede anti-virusantistoffer. Den virologiske metode har ringe brug på grund af virusets kulturelle kompleksitet. En klon af H9 lymfocytter bruges til at opnå virale antigener - de nødvendige komponenter i diagnostiske testsystemer. CDR-metoden gør det muligt at registrere viruset allerede i et tidligt stadium af viremia.
Behandling af HIV-infektion
Det er nødvendigt at finde eller syntetisere lægemidler effektivt inhibere revers transkriptase-aktivitet (revers transkriptase), eller en viral protease. De ville forhindre dannelsen af DNA-provirus og (eller) inhibere den intracellulære multiplikation af virusen. Moderne strategi for behandling af HIV-inficerede patienter er baseret på princippet om kombineret anvendelse af lægemidler, der hæmmer den virale protease (en af narkotika) og revergazu (2 forskellige lægemiddel), - kombineret (triple) terapi. I Rusland, til behandling af HIV-smittede mennesker anbefalede den kombinerede brug af to lokale lægemidler: Crixivan Phosphazide og specifikt hæmmer formeringen af hiv i de tidlige og sene stadier af avl, især med reduceret aktivitet af AZT.
Problemet med specifik forebyggelse er behovet for at skabe en vaccine, der ville sikre dannelsen af effektiv celle-medieret immunitet baseret på virusspecifikke cytotoksiske lymfocytter uden nogen væsentlig produktion af antistoffer. En sådan immunitet er tilvejebragt af Thl-helpers. Det er muligt, at antistoffer, herunder virusneutraliserende, ikke kun er ineffektive til at undertrykke HIV-infektion, men på et højt niveau undertrykker de cellemedieret immunitet. Derfor bør anti-HIV-vaccinen primært opfylde to grundlæggende krav: a) være absolut sikker og b) stimulere aktiviteten af T-cytotoksiske lymfocytter. Effektiviteten af forskellige varianter af vacciner opnået fra dræbte (inaktiverede) vira og fra individuelle antigener med høje beskyttende egenskaber studeres. Sådanne antigener kan enten isoleres fra virionerne selv eller syntetiseres kemisk. En vaccine baseret på gentekniske metoder foreslås. Det er en rekombinant vacciniavirus, der bærer hiv-gener, der er ansvarlige for syntese af antigener med stærke immunogene egenskaber. Beslutningen om effektiviteten af disse vacciner tager lang tid på grund af den lange varighed af inkubationsperioden for hiv-infektion og patogenes store variabilitet. At skabe en meget effektiv vaccine mod hiv er et presserende grundlæggende problem.


 [
[