Medicinsk ekspert af artiklen
Nye publikationer
Medicin
Lægemidler, der forebygger trombose og forbedrer blodets reologi
Sidst revideret: 07.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
For at forebygge dannelsen af flere mikrotromber under chok og deres destruktion kan forskellige farmakologiske tilgange anvendes, der anvender lægemidler, der forhindrer trombedannelse og forbedrer blodets reologi:
- eliminering af systemiske hæmodynamiske og mikrocirkulationsforstyrrelser ved hjælp af vasoaktive og inotrope midler;
- foranstaltninger til forbedring af blodreologi ved hjælp af rationel infusionsterapi og lægemidler, der genopretter elasticiteten af erytrocytmembraner (trental eller pentoxifyllin);
- forebyggelse af blodpladeaggregering og dannelse af initiale "hvide" tromber i små arterielle kar med efterfølgende initiering af koagulationskaskaden;
- hæmning af trombedannelse efter aktivering af den systemiske koagulationskaskade;
- aktivering af fibrinolyse med det formål at opløse nydannede blodpropper (fibrinolysin, streptokinase, streptodecase, urokinase osv.) eller tværtimod hæmning af fibrinolyse, når den generaliseres hos nogle patienter med traumatisk shock og sepsis (aminocapronsyre, amben, contracal osv.).
De fleste af de anførte tilgange er traditionelle, veludviklede i praksis med behandling af shock, har deres egne hæmorologiske indikationer og er specificeret i de relevante kapitler. Derfor er det i dette afsnit tilrådeligt at dvæle ved overvejelsen af den generelle tilgang til forebyggelse af trombedannelse i shock ved hjælp af farmakologiske midler, der påvirker profasen af blodkoagulation. Det er dette niveau af forebyggelse af koagulationskomplikationer - forekomsten, dannelsen og væksten af "hvide arterielle tromber" - der tiltrækker forskernes største opmærksomhed.
Forskellige og ofte multidirektionelle forstyrrelser i blodkoagulation med forringelse af dens reologi er karakteristiske for forskellige typer chok. Det mest karakteristiske for septisk, endotoksin-, forbrændings-, traumatisk og hæmoragisk chok er dannelsen af flere mikrotromber i de mindste kar, forårsaget af forstyrrelser i systemisk hæmodynamik, vasospasme og mikrocirkulationsforstyrrelser, blodfortykkelse, slamdannelse, nedsat elasticitet af erytrocytmembraner, samt talrige generelle og lokale faktorer (autocoider), der initierer lokale ændringer i koagulationshæmostasen og inklusion af blodkoagulationsprofasen.
I en skematisk (forkortet) form præsenteres den indledende fase af hæmokoagulation og mekanismen for lokal hæmokoagulationshomeostase som følger.
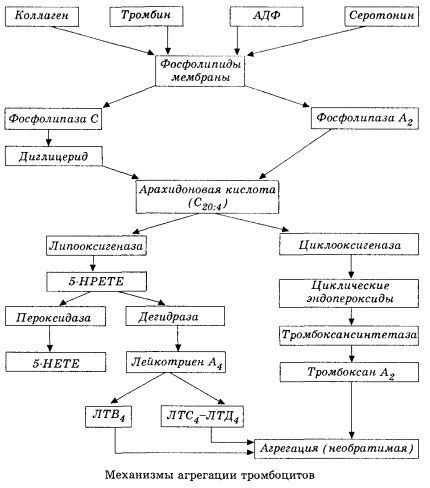
Det begynder med aktiveringen af membranfosfolipase A2 som følge af påvirkningen af en kombination af skadelige faktorer (direkte membranskade, hypoxi, lipidperoxidation, påvirkningen af endogene kemiske faktorer osv.). Som følge af nedbrydningen af membranfosfolipider frigives ikke-esterificerede langkædede fedtsyrer, hvoraf arachidonsyre er det vigtigste som et initialt substrat. Dens transformation (arachidonsyrekaskade) sker via lipoxygenase (syntese af leukotriener) og cyclooxygenase (syntese af prostaglandiner, thromboxaner, prostacyclin) veje.
De resulterende leukotriener (B4, C4, E4, D4 osv.) - stoffer med ekstremt høj biologisk aktivitet, som inkluderer det langsomt reagerende stof fra anafylaksi - er af stor betydning for initieringen af lokale vaskulære, inflammatoriske og immunreaktioner, herunder autoimmune processer. Leukotriener forårsager mikrocirkulationsforstyrrelser, øget blodkoagulation, frigivelse af autolytiske lysosomale enzymer og frigivelse i blodet af en faktor, der hæmmer myokardiets kontraktilitet og bronkial spasme.
På grund af deres evne til at forårsage glat muskulaturkontraktion påvirker leukotriener signifikant den systemiske hæmodynamik, koronarkarrene og myokardiet, idet de udøver en kraftig koronarkonstriktor og negativ inotrop effekt, som ledsages af et fald i hjertets minutvolumen og spiller en vigtig rolle i udviklingen af hypotension.
Reduceret hjertevolumen og hypotensiv respons på leukotriener er forbundet med svækkelse af hjertemusklen og begrænsning af venøs tilbageløb til hjertet. Af væsentlig betydning for at begrænse venøs tilbageløb er leukotrieners evne til at øge permeabiliteten af karvæggen og forårsage plasmaekstravasation. Leukotriener anses for at være vigtige i patogenesen af myokardieinfarkt.
Ved anafylaktisk og septisk (endotoksin) shock øges deres rolle tilsyneladende endnu mere, hvilket fremgår af leukotrieners evne til at akkumulere sig i betydelige mængder i plasma under allergiske reaktioner og forårsage ændringer i den systemiske blodgennemstrømning, der er karakteristisk for anafylaktisk shock, samt de beskyttende virkninger af leukotrienreceptorblokkere og lipoxygenasehæmmere. Udviklingen af selektive leukotrienreceptorblokkere udføres ret intensivt og er en lovende videnskabelig retning. På dette område er der allerede opnået en vis succes, og effektiviteten af sådanne blokkere ved myokardieiskæmi, endotoksin og hæmoragisk shock er blevet eksperimentelt bekræftet. Det vil dog sandsynligvis tage flere år, før denne retning implementeres klinisk.
Hvis der dannes tromber i venøse kar med lige stor deltagelse af trombocytter og plasmakoagulationsfaktorer, er trombocytter de vigtigste initiativtagere til processen i arterierne. De indeholder ADP, Ca2+, serotonin, fosfolipider, enzymer af prostaglandin- og tromboxansyntese, trombosthenin (ligesom muskelactomyosin, der sørger for disse cellers kontraktile evne), trombogen vækstfaktor i epitel- og muskelceller i karvæggen og en række andre stoffer. Humoral regulering af trombocytfunktioner udføres gennem specialiserede receptorer i deres membraner (alfa2- og beta2-adrenoreceptorer, receptorer for histamin og serotonin, acetylcholin, tromboxan, adenosin og en række andre). En særlig egenskab ved trombocytter er en høj affinitet for kollagen og andre subendotelelementer i karvæggen, for ikke-befugtende og negativt ladede overflader. Denne egenskab giver trombocytter en exceptionel evne til at klæbe til en del af et kar med beskadiget endotel, som har rig mulighed for at blive beskadiget under chok. I dette tilfælde spreder trombocytterne sig ud og frigiver pseudopodier, som kan klæbe til hinanden og til karvæggen. Membranpermeabiliteten øges, og ADP, serotonin, tromboxan og nogle koagulationsfaktorer adsorberet på trombocyttens overflade frigives fra trombocytterne. Disse stoffer interagerer med de tilsvarende receptorer på membranen og forårsager, med deltagelse af calciumioner, aggregering (initialt reversibel). Processen bliver selvopretholdende, hvilket fremmes af humorale regulatoriske faktorer; andre faktorer kan derimod stoppe den og endda vende den, hvilket forårsager disaggregering.
Med overvægt af trombedannende påvirkninger og betingelser erstattes adhæsions- og reversible aggregeringsfaser af den tredje fase - irreversibel aggregering, som udføres med deltagelse af thrombosthenin og fører til indsnævring af blodproppen; reaktionen med styrkelse af aggregationen og indsnævring forekommer også med deltagelse af Ca+, ATP og fører til dannelsen af en hvid trombe.
Cyclooxygenase-signalvejen for arachidonsyreomdannelse i blodplader, vaskulære endotelceller og andre væv sikrer lokal (metabolitternes halveringstid er meget kort) koagulationshomeostase, da der under denne metabolisme dannes kraftige pro- og antiaggregerende stoffer. Hovedfaktoren, der aktiverer blodpladeaggregering i cyclooxygenasekæden af reaktioner, er thromboxan A2, og dens ikke mindre kraftige antagonist er prostacyclin, produceret af endotelceller, og i mindre grad prostaglandiner i E- og G-serien. Endelig er blodpladeaggregering stærkt påvirket af yderligere lokale og systemiske humorale faktorer.
Blodpladeaggregeringsaktivatorer og -hæmmere
Initiatorer og aktivatorer af blodpladeaggregering |
Blodpladeaggregeringshæmmere |
Kollagen |
- |
ADP |
Adenosin og dets stabilisatorer |
Noradrenalin (via alfa2-receptorer) |
Alfa-adrenerge blokeringsmidler |
Serotonin |
Antiserotoninmidler |
Histamin |
Antihistaminer |
Trombin |
Heparin |
Ca2+ |
Ca2+-antagonister |
CGMP - dets induktorer (acetylcholin?) og stabilisatorer |
CAM - dets induktorer (via beta-adrenerge receptorer) og stabilisatorer (fosfodiesterasehæmmere) |
Arachidonsyre |
Dextraner, albumin |
Tromboxan A2 |
Prostacyklin I2 |
Farmakologiske interventioner i den indledende fase af trombedannelse i shock og akutte iskæmiske processer i hjertet og hjernen antyder følgende mulighed:
- hæmning af indledende reaktioner (total og delvis) af arachidonsyrekaskaden;
- hæmning af en bestemt reaktion af thromboxansyntese;
- blokade af receptorer for leukotriener og thromboxaner i blodplader, glat muskulatur og andre celler;
- brugen af stoffer, der modulerer blodpladeaggregering, dvs. på andre måder svækker sidstnævntes reaktion på påvirkningen af initierende faktorer (kollagen, thromboxan A2, leukotriener osv.).
Implementeringen af de anførte metoder til korrektion af forstyrrelser i blodets rheologiske egenskaber muliggør løsningen af den vigtigste taktiske opgave: at beskytte receptorer for aggregering og adhæsion af blodplader mod virkningen af aktivatorer eller at undertrykke intracellulære syntesemekanismer af disse receptorer. Hæmning af de indledende reaktioner i arachidonsyrekaskaden kan opnås ved at beskytte blodpladereceptorer, der reagerer på polymeraktivatorer, ved hjælp af lavmolekylære dextraner, hvis molekyler konkurrerer med fibrin, kollagen, aggregeret immunoglobulin (IgE) og komponenter i komplementsystemet.
Ved at maskere receptorerne på blodplademembranen og konkurrere med storspredte proteiner på overfladen af erytrocytter, fortrænger lavmolekylære dextraner dem og ødelægger broerne mellem cellerne. Dette skyldes, at dextraner, der omslutter det vaskulære endotel og overfladen af blodcelleelementer, øger deres negative ladning og derved forbedrer deres antiaggregeringsegenskaber.
Dextraner
Lavmolekylære dextraner reducerer kollagen- og ADP-induceret blodpladeaggregering, såvel som trombins aktiverende effekt på blodplader, hæmmer væksten af den initiale hvide blodpladetrombe, forbedrer blodgennemstrømningen, reducerer den postoperative stigning i plasmafibrinogenindhold og ændrer fibrins struktur og stabilitet.
Intravenøse infusioner af dextraner ved traumer og chok reducerer ikke kun trombocytaggregation og adhæsion, men mobiliserer også endogent heparin, hvorved dannelsen af en løs og svært tilbagetrækkelig blodprop, som let lyseres af fibrinolytika. Antitrombinaktiviteten af lavmolekylære dextraner er forbundet med deres specifikke effekt på strukturen og funktionen af blodkoagulationsfaktor VIII. Faktor VIII (antihæmofil globulin), et stort molekyle med en kompleks struktur og funktion, er involveret i trombocytaggregation og stabiliteten af den resulterende prop. Dextraner forstyrrer virkningen af faktor VIII, hvorved trombocytaggregationen bremses og propstabiliteten reduceres.
Lavmolekylære dextraner er ikke ægte antikoagulantia, og deres korrigerende effekt ved hæmoreologiske lidelser er primært forbundet med hæmodilution, genopfyldning af cirkulerende plasmavolumen og forbedring af blodgennemstrømningen i mikrocirkulationssystemet.
Dextranernes evne til at forbedre blodgennemstrømningen ved hæmodynamiske lidelser (chok, blodtab) skyldes en række faktorer. Forekomsten af en høj, forbigående koncentration af polymeren i blodet fører ikke kun til "direkte hæmodilution", men skaber også betingelser for væskestrømning fra det interstitielle rum ind i blodbanen og den efterfølgende afbalancering af dextranens osmotiske effekt. Som følge af hæmodilution falder blodets viskositet, den venøse tilstrømning til hjertet øges, og hjertets minutvolumen øges. Sammen med disse effekter danner dextraner komplekser med fibrinogen og har en antilipæmisk effekt.
Således bidrager den antiaggregerende virkning og de hæmodynamiske effekter af lavmolekylære dextraner til at reducere blodets viskositet, hvilket er særligt vigtigt ved lave forskydningshastigheder. Disaggregering af blodlegemer forbedrer systemisk blodgennemstrømning og mikrocirkulation, især i den venøse del, hvor hastighedsgradienterne er lavest. Brugen af lavmolekylære dextranopløsninger ved forskellige typer chok, under kirurgisk behandling af skader og deres konsekvenser, og derefter i den postoperative periode, hjælper med at forhindre hyperkoagulation og reducere sandsynligheden for trombotiske processer og emboli.
Det skal dog bemærkes, at infusioner af dextranopløsninger i nogle tilfælde ledsages af anafylaktiske og allergiske reaktioner (farlige i nærvær af sensibilisering og anafylaktisk shock). Dette skyldes, at dextraner, som har en høj molekylvægt og mange sidekæder, kan fungere som et antigen. For at fastslå individuel følsomhed anbefales det derfor at præadministrere intravenøst op til 20 ml af en lavmolekylær dextranopløsning som en hapten (15% opløsning, molekylvægt 1000) og udføre infusioner af en plasmaerstatning før indførelse af anæstesi.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ], [ 17 ], [ 18 ]
Trombinhæmmere
Farmakologisk beskyttelse af trombocytreceptorer, der interagerer med trombocytaktivatorer, kan også opnås ved hjælp af midler, der konkurrerer med ikke-polymere trombocytaktivatorer eller hæmmer dem. Sådanne midler omfatter trombinhæmmere (heparin og hirudin, en række syntetiske hæmmere, adrenalinantagonister), alfa-receptorblokkere (phentolamin, dihydroergotamin), ADP-antagonister (dipyridamol, adenosin og dets strukturelle analoger, fosfokreatin) og serotoninantagonister (methysergid). Kun få af de anførte midler anvendes faktisk til forebyggelse og behandling af shock af forskellig oprindelse.
Beskyttelse af intracellulære syntesemekanismer af proteinreceptorer, der reagerer med aktivatorer af blodpladeaggregering og adhæsion, og hæmning af thromboxansynteseprocesser er mulig med lægemidler fra forskellige grupper:
- induktorer og stabilisatorer af cATP, prostacyclin og prostaglandin PgE2;
- fosfolipase- og fosfodiesterasehæmmere.
Intensiv udvikling af specielle antitrombocytmidler begyndte relativt nylig og har endnu ikke ført til pålidelige resultater. I øjeblikket anvendes i klinisk praksis, udover dextranopløsninger, sådanne antitrombocytmidler som acetylsalicylsyre, indomethacin, dipyradamol, sulfinpyrazon (persantin), prostacyclin (eicoprostenon) og heparin i vid udstrækning til at forhindre dannelsen af hvide blodpladetromber.
Ikke-steroide antiinflammatoriske lægemidler
Det er blevet fastslået, at de farmakologiske virkninger af ikke-steroide antiinflammatoriske lægemidler - acetylsalicylsyre og indomethacin - skyldes deres virkning på metabolismen af eicosanoider (thromboxaner og prostaglandiner). Næsten alle lægemidler i denne gruppe hæmmer enzymkomplekset kendt som prostaglandinsyntetase og udøver derved deres specifikke og antiaggregerende virkning.
Acetylsalicylsyre absorberes meget hurtigt efter oral administration. Produktet af dets hydrolyse, salicylsyre, forårsager hæmning af blodplade-cyclooxygenase, hvilket forstyrrer omdannelsen af arachidonsyre til prostaglandin O2 og i sidste ende thromboxan A2. Acetylsalicylsyre hæmmer aggregering induceret af kollagen, ADP, adrenalin og serotonin. Selvom dens GG05 er 15 minutter, varer den antiaggregerende effekt i flere dage, hvilket tilsyneladende forklares ved irreversibel hæmning af prostaglandinsyntesereaktioner og undertrykkelse af blodpladeaggregeringsfunktionen gennem hele deres levetid (6-10 dage). Sammen med hæmning af blodplade-cyclooxygenase hæmmer acetylsalicylsyre i høje doser cyclooxygenase i vaskulærvæggen, og samtidig med undertrykkelse af thromboxan A2-syntese hæmmer den prostacyclinsyntese i endotelceller. Derfor bør acetylsalicylsyre ordineres som et antiaggregeringsmiddel i små doser (3000-5000 mg/dag), hvilket overvejende hæmmer blodpladeaggregering.
I betragtning af at acetylsalicylsyre blokerer trombocyt-cyclooxygenase i flere dage, og endotel-cyclooxygenase - ikke mere end en dag, er det rationelt at ordinere lægemidlet ikke dagligt, men hver 3.-4. dag. Valget af den optimale dosis acetylsalicylsyre til patienten bør udføres individuelt, da patienternes følsomhed over for lægemidlets antitrombocyteffekt varierer. Hos reaktive patienter hæmmer acetylsalicylsyre i en dosis på 0,5 g trombocytaggregationen med 40-50%, hos hyperreaktive patienter - fuldstændigt eller med 80-90%, og for reaktive patienter er fraværet af en antitrombocyteffekt karakteristisk, når man tager den samme dosis af lægemidlet.
Selektive thromboxansyntetasehæmmere er imidazol og dets analoger, som ikke blokerer cyclooxygenase. Dipyridamol, der anvendes i klinisk praksis til behandling af kronisk iskæmisk hjertesygdom som en koronar dilatator, hæmmer ligesom imidazol selektivt thromboxansyntetase og forhindrer syntesen af thromboxan A2. Lægemidlet og dets analoger menes også at hæmme blodpladephosphodiesterase og derved øge koncentrationen af cAMP i blodplader. Samtidig hæmmer dipyridamol aktiviteten af adenosindeaminase og blodpladernes optagelse af adenosin, blokerer blodpladernes absorption af serotonin og deres aggregering induceret af adrenalin og kollagen. Der er rapporter om svag antitrombocytaktivitet af lægemidlet og dets evne til i små doser at forbedre blodpladeaggregeringen. Den mest pålidelige antitrombocyteffekt kan opnås med en kombination af dipyridamol og acetylsalicylsyre.
Heparin
Blandt antitrombotiske midler er heparin en af de mest effektive regulatorer af blodets aggregerede tilstand, især når det anvendes tidligt. Heparin har en høj negativ ladning og er i stand til at interagere med både store og små ioner og molekyler (enzymer, hormoner, biogene aminer, plasmaproteiner osv.), så spektret af dets biologiske virkning er ret bredt. Lægemidlet har antitrombin-, antitromboplastin- og antiprotrombin-effekter, forhindrer omdannelsen af fibrinogen til fibrin, undertrykker tilbagetrækning af blodpropper og øger fibrinolysen.
Mekanismen bag heparins antikoagulerende virkning er ret kompleks. Det er nu blevet fastslået, at heparins antikoagulerende virkninger er forbundet med en potensering af antitrombin III's virkning og en forbedring af heparin-antitrombin III-kompleksets evne til hurtigt at inaktivere de fleste serinproteaser i blodkoagulationssystemet. I heparins antitrombotiske virkning er dets evne til at øge og opretholde et højt elektronegativt potentiale i den vaskulære intima, hvilket forhindrer blodpladeadhæsion og dannelsen af blodplademikrotromber, af stor betydning. Heparin undertrykker mest aktivt trombedannelse i vener og forhindrer både lokal trombedannelse og dissemineret intravaskulær koagulation.
Prostacyclin og dets stabile analoger
Blandt antitrombocytmidler er de mest kraftfulde aggregationshæmmere prostacyclin og dets stabile analoger. Prostacyclins antitrombocyteffekt skyldes stimulering af adenylatcyklase og som følge heraf en stigning i koncentrationen af cAMP i blodplader, et fald i indholdet af thromboxan, et fald i indholdet af thromboxan A2 og blokade af dets receptorer. Prostacyclin er ustabilt og hydrolyseres hurtigt til inaktive produkter, så det administreres intravenøst ved drop med en hastighed på 2 til 20 ng/kg pr. minut i 30-60 minutter op til 6 gange om dagen.
Prostacyclin har, sammen med en stærk antiaggregatorisk effekt, en kraftig vasodilatorisk og bronkodilatorisk effekt. Lægemidlet udvider karrene i hjernen, hjertet, nyrerne, skeletmuskulaturen og mesenteriske kar. Under påvirkning af prostacyclin øges den koronare blodgennemstrømning, energiforsyningen til myokardiet øges, og dets behov for ilt falder. Trods dets ustabilitet i kroppen kan klinisk gunstige virkninger vare i flere uger og endda måneder. Mekanismen for en sådan langvarig virkning er endnu ikke klar.
Prostacyclin er et lavtoksisk lægemiddel, men dets brug kan forårsage bivirkninger: ansigtsrødmen, hovedpine, nedsat blodtryk, mavesmerter, anoreksi. Sammen med prostacyclin er dets syntetiske stabile analoger (iloprost osv.) lovende hæmmere af blodpladeaggregering.
Medicin, der forbedrer blodets viskositet
Forstyrrelser i blodets reologiske egenskaber under traumer og chok skyldes ikke kun ændringer i blodpladernes funktionelle aktivitet, men også en stigning i blodets viskositet. Blodets strukturelle viskositet som et komplekst dynamisk dispergeret system bestemmes i høj grad af plasmaets viskositet og erytrocytternes evne til at deformeres. Plasmaviskositeten afhænger hovedsageligt af koncentrationen af proteiner i blodet. Proteiner med en lav molekylvægt, såsom albumin, har ringe effekt på plasmaviskositeten, mens proteiner med et stort molekyle (fibrinogen, alfa- og gammaglobuliner, andre makromolekyler) øger den betydeligt.
Ved lave forskydningshastigheder fører adsorption af fibrinogen og globuliner på overfladen af erytrocytter til dannelsen af broer mellem tilstødende celler og dannelsen af aggregater fra erytrocytter. Dannelseshastigheden af aggregater er en kompleks biofysisk proces og afhænger ikke kun af forskydningens størrelse, men også af erytrocytternes elektrokinetiske egenskaber, koncentrationen, massen og sorptionskapaciteten af makromolekylerne-aggregatorerne samt erytrocytternes form og plasticitet.
Det kræver et betydeligt energiforbrug at opretholde erytrocytmembranens form og mekaniske egenskaber. Det menes, at den energi, der produceres i erytrocytter under glykolysen, bruges på fosforylering af spektrin, hvilket resulterer i ændringer i proteinets sekundære struktur og interaktion med tilstødende komponenter i den indre membran. Interaktionen mellem membranens strukturelle proteiner, spektrin og aktin, spiller en vigtig rolle i dannelsen af erytrocytmembranens mekaniske egenskaber, idet den opretholder et konstant overfladeareal af erytrocytten og dens tykkelse under enhver deformation.
Ved systemiske hæmodynamiske og organblodgennemstrømningsforstyrrelser fører øget stivhed af erytrocytmembraner og dannelsen af erytrocytaggregater til et fald i erytrocytternes passagehastighed gennem kapillærer, hvorved blodets gastransportfunktion forstyrres. Derfor bør korrektion af forstyrrelser i blodets rheologiske egenskaber i chok, sammen med forebyggelse af erytrocytaggregering, omfatte normalisering af plasma- og blodviskositet, aggregering og deformation af erytrocytter.
Ud over lavmolekylære dextraner er albuminopløsninger et effektivt middel til at øge blodets suspensionsstabilitet. I den sene periode med chok forekommer generaliseret aggregering af erytrocytter på baggrund af et fald i koncentrationen af albumin i blodplasmaet og en stigning i koncentrationen af fibrinogen og globuliner, især alfa2-fraktionen, lipoproteiner og lipider. Under disse forhold skyldes albumins reologiske virkninger to hovedfaktorer: hæmodilution og normalisering af forholdet mellem mikro- og makroglobulære proteiner i plasma. Samtidig binder albumin frie syrer, hvis stabilisering under traumer og chok stimulerer aggregeringen af blodets cellulære strukturer og intravaskulær koagulation og kan forårsage fedtemboli.
Antichokforanstaltninger, der sigter mod at genopfylde mængden af cirkulerende blod, eliminere vævshypoksi og metabolisk acidose, bidrager til normalisering af erytrocytmembranernes elasticitet, da hypoxi og acidose reducerer erytrocytternes deformerbarhed betydeligt. Øget stivhed af erytrocytmembraner under chok er sandsynligvis forbundet med hæmning af ATP-syntese i erytrocytter. Til gengæld bidrager et fald i ATP-koncentrationen til en stigning i Ca2+-koncentrationen i erytrocytter, som ved at binde sig til membranproteiner øger membranens stivhed.
Et af de farmakologiske lægemidler, der øger ATP-indholdet i erytrocytter og elasticiteten af erytrocytmembraner, er Trental (pentoxifyllin), som anvendes i klinisk praksis til behandling af iskæmiske lidelser.
Udover at reducere stivheden af erytrocytmembraner forårsager Trental vasodilatation, forbedrer vævsoxygenering, hæmmer fosfodiesteraseaktivitet i væv, øger cAMP-koncentrationen og hæmmer blodpladeaggregering.
Blandt andre farmakologiske midler, der opretholder erytrocytmembranens elasticitet, er det værd at bemærke Ca2+-antagonister, som begrænser strømmen af ioner ind i erytrocytter (flunarizin, nifedipin osv.).
 [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Opmærksomhed!
For at forenkle opfattelsen af information, er denne instruktion til brug af lægemidlet "Lægemidler, der forebygger trombose og forbedrer blodets reologi" oversat og præsenteret i en speciel form på grundlag af de officielle instruktioner til medicinsk brug af stoffet. Før brug skal du læse annotationen, der kom direkte til medicinen.
Beskrivelse er givet til orienteringsformål og er ikke vejledning til selvhelbredelse. Behovet for dette lægemiddel, formålet med behandlingsregimen, metoder og dosis af lægemidlet bestemmes udelukkende af den behandlende læge. Selvmedicin er farligt for dit helbred.

