Medicinsk ekspert af artiklen
Nye publikationer
Årsager og patogenese af difteri
Sidst revideret: 04.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
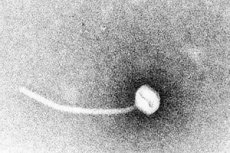
Difteri er et paradigme for toksigene infektionssygdomme. I 1883 demonstrerede Klebs, at Corynebacterium diphtheriae var det forårsagende agens for difteri. Et år senere fandt Loeffler, at organismen kun kunne dyrkes fra næsesvælget og foreslog, at skaden på indre organer skyldtes et opløseligt toksin. I 1888 viste Roux og Yersin, at dyr injiceret med sterile filtrater af C. diphtheriae udviklede organpatologi, der ikke kunne skelnes fra den hos menneskelig difteri; dette demonstrerede, at et potent eksotoksin var den vigtigste virulensfaktor.
Difteri er oftest en infektion i de øvre luftveje, der forårsager feber, ondt i halsen og utilpashed. En tyk, grågrøn fibrinmembran, en pseudomembran, dannes ofte på infektionsstedet/-stederne som følge af de kombinerede virkninger af bakterievækst, toksinproduktion, underliggende vævsnekrose og værtens immunrespons. Erkendelsen af, at systemisk organskade skyldes virkningen af difteritoksin, har ført til udviklingen af både effektiv antitoksinbaseret terapi til behandling af akut infektion og en yderst effektiv toksoidvaccine.
Selvom toxoidimmunisering har gjort difteri til en sjælden sygdom i områder, hvor folkesundhedsstandarder kræver vaccination, forekommer udbrud af difteri stadig i uimmuniserede og immunkompromitterede grupper. I modsætning hertil er der forekommet udbredte udbrud af difteri, der har nået epidemiske proportioner, i områder, hvor aktive immuniseringsprogrammer har været suspenderet.
Andre typer af corynebakterier
Ud over C. diphtheriae, C. ulcerans og C. pseudotuberculosis kan C. pseudodiphtheriticum og C. xerosis lejlighedsvis forårsage nasofaryngeale og hudinfektioner. De to sidstnævnte stammer er genkendelige ved deres evne til at producere pyrazinamidase. Inden for veterinærmedicin er C. renale og C. kutscheri vigtige patogener, der forårsager henholdsvis pyelonefritis hos kvæg og latente infektioner hos mus.
Årsager
Det forårsagende agens for difteri, Corynebacterium diphtheriae, er en tynd, let buet stav med kølleformede fortykkelser i enderne, ubevægelig; den danner ikke sporer, kapsler eller flageller og er grampositiv.
Ud over toksinet producerer difteri-corynebakterier neuraminidase, hyaluronidase, hæmolysin, nekrotiserende og diffuse faktorer under deres livsprocesser, hvilket kan forårsage nekrose og fortætning af bindevævets hovedsubstans.
Baseret på deres evne til at danne toksin er difteri-corynebakterier opdelt i toksigene og ikke-toksigene.
Difteritoksin er et potent bakterielt eksotoksin, der bestemmer både generelle og lokale kliniske manifestationer af sygdommen. Toksigenicitet er genetisk bestemt. Ikke-toksogene difteri-corynebakterier forårsager ikke sygdommen.
I henhold til kulturelle og morfologiske træk er alle difteri-corynebakterier opdelt i 3 varianter: gravis, mitis, intermedius. Der er ingen direkte afhængighed af sygdommens sværhedsgrad på varianten af difteri-corynebakterier. Hver variant indeholder både toksogene og ikke-toksogene stammer. Toksigene corynebakterier af alle varianter producerer et identisk toksin. [ 1 ]
Struktur, klassificering og antigentyper
Corynebacterium diphtheriae er en grampositiv, ikke-bevægelig, kølleformet stav. Stammer, der vokser i væv eller ældre in vitro-kulturer, indeholder fine pletter i cellevæggene, der tillader affarvning under gramfarvning og resulterer i en variabel gramreaktion. Ældre kulturer indeholder ofte metakromatiske granuler (polymetafosfat), der farver blålig-lilla med methylenblåt. Cellevægssukkerarter omfatter arabinose, galactose og mannose. Derudover kan den giftige 6,6'-ester af trehalose isoleres, der indeholder corynemycolsyre og corynemycolensyre i ækvimolære koncentrationer. Tre forskellige kulturtyper genkendes: mitis, intermedius og gravis.
De fleste stammer kræver nikotinsyre og pantothensyre for vækst; nogle kræver også thiamin, biotin eller pimelinsyre. For optimal produktion af difteritoksin skal mediet suppleres med aminosyrer og sættes til side.
Allerede i 1887 beskrev Loeffler isoleringen af avirulente (ikke-toksogene) C. diphtheriae, der ikke kunne skelnes fra virulente (toksogene) stammer isoleret fra patienter hos raske individer. Det er nu anerkendt, at avirulente stammer af C. diphtheriae kan omdannes til en virulent fænotype efter infektion og lysogenisering af en af en række forskellige corynebakteriofager, der bærer det strukturelle gen for difteritoksin, tox. Lysogen omdannelse af den avirulente til virulente fænotype kan forekomme både in situ og in vitro. Det strukturelle gen for difteritoksin er ikke essentielt for hverken corynebakteriofag eller C. diphtheriae. På trods af denne observation er genetisk drift af difteritoksin ikke blevet observeret.
Patogenese
Indgangspunkterne for infektion er slimhinderne i orofarynx, næse, larynx, sjældnere slimhinderne i øjne og kønsorganer, samt beskadiget hud, sår- eller forbrændingsflader, bleudslæt, uhelet navlestreng. Ved indgangspunktet formerer difteri-corynebakterien sig og udskiller eksotoksin.
Fibrinogenrigt ekssudat udskilles og omdannes til fibrin under påvirkning af trombokinase, der frigives under nekrose af epitelceller. Der dannes en fibrinøs film - et karakteristisk tegn på difteri.
Asymptomatisk nasopharyngeal bæring er almindelig i difteri-endemiske områder. Hos modtagelige individer forårsager toksogene stammer sygdom ved at replikere og udskille difteritoksin i nasopharynx eller hudlæsioner. Difterilæsionen er ofte dækket af en pseudomembran bestående af fibrin, bakterier og inflammatoriske celler. Difteritoksin kan proteolytisk spaltes i to fragmenter: N-terminalt fragment A (katalytisk domæne) og fragment B (transmembrane og receptorbindende domæner). Fragment A katalyserer NAD+-afhængig ADP-ribosylering af elongationsfaktor 2 og hæmmer derved proteinsyntese i eukaryote celler. Fragment B binder til en celleoverfladereceptor og letter levering af fragment A til cytosolen.
Beskyttende immunitet involverer antistofresponset på difteritoksin efter klinisk sygdom eller på difteritoksin (toksin inaktiveret af formaldehyd) efter immunisering.
Kolonisering
Man ved kun lidt om de faktorer, der medierer kolonisering af C. diphtheriae. Det er dog klart, at andre faktorer end produktion af difteritoksin bidrager til virulens. Epidemiologiske undersøgelser har vist, at en given lysotype kan overleve i en population i lange perioder. Den kan senere blive erstattet af en anden lysotype. Fremkomsten og den efterfølgende dominans af en ny lysotype i en population er formodentlig relateret til dens evne til at kolonisere og konkurrere effektivt i sit segment af den nasopharyngeale økologiske niche. Corynebacterium diphtheriae kan producere neuraminidase, som spalter celleoverfladesialinsyre i dens komponenter pyruvat og N-acetylneuraminsyre. Cordefaktor (6,6'-di-O-mycoloyl-α, α'-D-trehalose) er en overfladekomponent af C. diphtheriae, men dens rolle i kolonisering af den menneskelige vært er uklar.
Produktion af difteritoksiner
Det strukturelle gen for difteritoksin, tox, tilhører en familie af nært beslægtede corynebakteriofager, hvoraf β-fagen er den bedst undersøgte. Regulering af difteritoksinekspression medieres af en jernaktiveret repressor, DtxR, som er kodet af C. diphtheriae-genomet. Toksinekspression afhænger af den fysiologiske tilstand af C. diphtheriae. Under forhold, hvor jern bliver det væksthastighedsbegrænsende substrat, dissocierer jern fra DtxR, toxicodendron-genet aktiveres, og difteritoksin syntetiseres og udskilles i dyrkningsmediet med maksimale hastigheder.
Difteritoksin er usædvanligt potent; for modtagelige arter (f.eks. mennesker, aber, kaniner, marsvin) er så lidt som 100 til 150 ng/kg kropsvægt dødeligt. Difteritoksin består af en enkelt polypeptidkæde på 535 aminosyrer. Biokemisk, genetisk og røntgenstrukturanalyse viser, at toksinet består af tre strukturelle/funktionelle domæner:
- N-terminal ADP-ribosyltransferase (katalytisk domæne);
- en region, der letter levering af det katalytiske domæne over cellemembranen (transmembrandomæne);
- eukaryot cellereceptorbindingsdomæne.
Efter mild trypsinfordøjelse og reduktion under denaturerende forhold kan difteritoksin specifikt spaltes ved sin proteasefølsomme løkke i to polypeptidfragmenter (A og B). Fragment A er den N-terminale 21 kDa-komponent af toksinet og indeholder det katalytiske sted for ADP-ribosylering af forlængelsesfaktor 2 (EF-2).
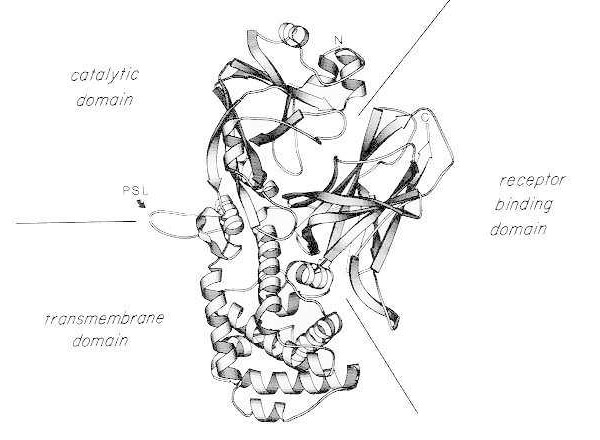
Bånddiagram af røntgenkrystalstrukturen af monomerisk nativt difteritoksin. (modificeret fra Bennett MJ, Choe S, Eisenberg D: Domain swapping: Entangling alliances between proteins. Proc Natl Acad Sci, USA, 91: 3127, 1994). De relative positioner af de katalytiske, transmembrane og receptorbindende domæner er vist. Det intakte toksin kan spaltes af trypsinlignende proteaser ved Arg190, Arg192 og/eller Arg193, som er placeret i den proteasefølsomme løkke (PSL). Efter reduktion af disulfidbroen mellem Cys186 og Cys201 kan toksinet opløses i A- og B-fragmenter. Aminoterminalen (N) og carboxyterminalen (C) af det intakte toksin er vist. Stribdiagrammet blev oprettet ved hjælp af MOLESCRIPT-programmet.
Det C-terminale fragment, fragment B, bærer toksinets transmembrane og receptorbindende domæner.
Forgiftning af en enkelt eukaryot celle med difteritoksin involverer mindst fire forskellige trin:
- binding af toksinet til dets receptor på celleoverfladen;
- klyngedannelse af ladede receptorer i belagte huller og internalisering af toksinet via receptormedieret endocytose; efter forsuring af den endocytiske vesikel af en membranassocieret, ATP-drevet protonpumpe,
- indsættelse af transmembrandomænet i membranen og lettet levering af det katalytiske domæne til cytosolen, og
- ADP-ribosylering af EF-2, hvilket resulterer i irreversibel undertrykkelse af proteinsyntese.
Det har vist sig, at et enkelt molekyle af det katalytiske domæne, der leveres til cytosolen, er tilstrækkeligt til at være letalt for cellen.
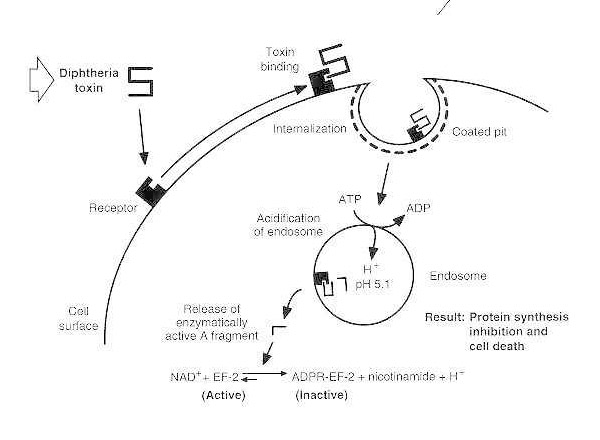
Skematisk diagram over difteriforgiftning af en modtagelig eukaryot celle.
Toksinet binder sig til sin celleoverfladereceptor og internaliseres via receptormedieret endocytose; ved forsuring af endosomet indsættes transmembrandomænet i vesikelmembranen; det katalytiske domæne leveres til cytosolen, hvilket fører til hæmning af proteinsyntese og celledød.
Epidemiologi
Før masseimmunisering af den amerikanske befolkning med difteritoksoid var difteri normalt en børnesygdom. Et bemærkelsesværdigt aspekt ved masseimmunisering med difteritoksoid er, at efterhånden som andelen af befolkningen med beskyttende niveauer af antitoksinimmunitet (≥ 0,01 IE/ml) stiger, falder hyppigheden af isolering af toksogene stammer fra befolkningen. I dag er isolering af toksogene stammer af C. diphtheriae sjælden i USA, hvor klinisk difteri næsten helt er forsvundet. Fordi subklinisk infektion ikke længere er en kilde til eksponering for difteriantigen, og medmindre den er boostet, aftager immuniteten over for antitoksin, har en stor procentdel af voksne (30 til 60%) antitoksinniveauer under beskyttende niveauer og er i risiko. I USA, Europa og Østeuropa er der primært forekommet udbrud af difteri blandt personer, der misbruger alkohol og/eller stoffer. Inden for denne gruppe har bærere af toksogene C. diphtheriae et moderat højt niveau af antitoksisk immunitet. Den nylige nedbrydning af folkesundhedsforanstaltningerne i Rusland har resulteret i, at difteri er blevet en epidemi. Ved udgangen af 1994 var der rapporteret mere end 80.000 tilfælde og mere end 2.000 dødsfald i Rusland.
Fokale udbrud af difteri er næsten altid forbundet med en immunbærer, der er vendt tilbage fra en region, hvor difteri er endemisk. Faktisk har nylige udbrud af klinisk difteri i USA og Europa været forbundet med rejsende, der vender tilbage fra Rusland og Østeuropa. Toksigene stammer af C. diphtheriae overføres direkte fra person til person via luftbårne dråber. Det er kendt, at toksigene stammer direkte kan kolonisere nasopharyngealt hulrum. Derudover kan det toksigene gen spredes indirekte ved frigivelse af toksigen corynebakteriofag og lysogen transformation af ikke-toksigen autokton C. diphtheriae in situ. [ 5 ]
Ud over biotype- og lysotypebestemmelse af C. diphtheriae-isolater kan molekylærbiologiske teknikker nu bruges til at studere difteriudbrud. Restriktionsendonukleasefordøjelsesmønstre af C. diphtheriae kromosomalt DNA er blevet brugt til at studere kliniske udbrud, ligesom brugen af klonede corynebakterielle insertionssekvenser som en genetisk probe.
Schick-testen har i mange år været brugt til at vurdere immunitet over for difteritoksin, selvom den nu i mange områder er blevet erstattet af den serologiske test for specifikke antistoffer mod difteritoksin. I Schick-testen injiceres en lille mængde difteritoksin (ca. 0,8 ng i 0,2 ml) intradermalt i underarmen (teststedet), og 0,0124 μg difteritoksin i 0,2 ml injiceres intradermalt i kontrolstedet. Aflæsninger tages efter 48 og 96 timer. Uspecifikke hudreaktioner topper normalt efter 48 timer. Efter 96 timer indikerer en erytematøs reaktion med en vis mulig nekrose på teststedet utilstrækkelig antitoksisk immunitet til at neutralisere toksinet (≤ 0,03 IE/ml). Inflammation i både test- og kontrolområdet efter 48 timer indikerer en overfølsomhedsreaktion over for antigenpræparatet.
Forms
Corynebacterium diphtheriae inficerer næsesvælget eller huden. Toksigene stammer producerer et potent eksotoksin, der kan forårsage difteri. Symptomer på difteri omfatter faryngitis, feber og hævelse af halsen eller området omkring hudlæsionen. Difterilæsioner er dækket af en pseudomembran. Toksinet spredes gennem blodbanen til fjerne organer og kan forårsage lammelse og hjertesvigt. [ 6 ]
Der er to typer klinisk difteri: nasofaryngeal og kutan. Symptomer på faryngeal difteri spænder fra mild faryngitis til hypoxi på grund af luftvejsobstruktion af en pseudomembran. Involvering af de cervikale lymfeknuder kan forårsage alvorlig hævelse af halsen (tyrehalsdifteri), og patienten kan udvikle feber (≥ 103°F). Hudlæsioner ved kutan difteri er normalt dækket af en gråbrun pseudomembran. Livstruende systemiske komplikationer, primært tab af motorisk funktion (f.eks. synkebesvær) og hjertesvigt, kan udvikle sig som følge af difteritoksins virkning på perifere motorneuroner og myokardiet.
Kontrollere
Bekæmpelse af difteri afhænger af tilstrækkelig immunisering med difteritoksoid: difteritoksin inaktiveret af formaldehyd, som forbliver antigenisk intakt. Toksoidet fremstilles ved at inkubere difteritoksin med formaldehyd ved 37°C under alkaliske forhold. Difteriimmunisering bør begynde i den anden levemåned med en serie af tre primære doser med 4- til 8-ugers intervaller, efterfulgt af en fjerde dosis cirka 1 år efter den sidste primære dosis. Difteritoksoid anvendes i vid udstrækning som en komponent i difteri-kighoste-tetanus (DPT)-vaccinen. Epidemiologiske undersøgelser har vist, at immunisering mod difteri er cirka 97% effektiv. Selvom masseimmunisering mod difteri praktiseres i USA og Europa, og børneimmuniseringsraterne er tilstrækkelige, kan en stor del af den voksne befolkning have antistoftitre under beskyttelsesniveauer. Voksne bør revaccineres med difteritoksoid hvert 10. år. Faktisk bør en boosterimmunisering med difteri-tetanus-toksoid gives til rejsende til områder med høj forekomst af endemisk difteri (Central- og Sydamerika, Afrika, Asien, Rusland og Østeuropa). I de senere år har brugen af højt oprensede toksoidpræparater til immunisering minimeret lejlighedsvise alvorlige overfølsomhedsreaktioner. En boosterimmunisering med difteri-tetanus-toksoid bør gives til rejsende til områder med høj forekomst af endemisk difteri (Central- og Sydamerika, Afrika, Asien, Rusland og Østeuropa). I de senere år har brugen af højt oprensede toksoidpræparater til immunisering minimeret lejlighedsvise alvorlige overfølsomhedsreaktioner. Boosterimmunisering med difteri-tetanus-toksoid bør gives til rejsende til områder med høj forekomst af endemisk difteri (Central- og Sydamerika, Afrika, Asien, Rusland og Østeuropa). I de senere år har brugen af højt oprensede toksoidpræparater til immunisering minimeret lejlighedsvise alvorlige overfølsomhedsreaktioner.
Selvom antibiotika (såsom penicillin og erythromycin) anvendes som en del af behandlingen af patienter med difteri, er hurtig passiv immunisering med difteri-antitoksin mest effektiv til at reducere dødeligheden. Den lange halveringstid for specifikt antitoksin i blodbanen er en vigtig faktor for at sikre effektiv neutralisering af difteri-toksin; for at være effektivt skal antitoksinet dog reagere med toksinet, før det kan trænge ind i cellen.
Reengineering af difteritoksin til udvikling af eukaryote receptorspecifikke cytotoksiner
Proteinteknologi er et nyt og hurtigt udviklende felt inden for molekylærbiologi; det kombinerer rekombinant DNA-metoder og fastfase-DNA-syntese for at designe og konstruere kimære gener, hvis produkter har unikke egenskaber. Studier af struktur-funktionsforholdene for difteritoksin har tydeligt vist, at dette toksin er et protein med tre domæner: katalytisk, transmembran og receptor. Det har været muligt genetisk at erstatte det native receptorbindende domæne af difteritoksin med forskellige polypeptidhormoner og cytokiner (f.eks. α-melanocytstimulerende hormon [α-MSH], interleukin (IL) 2, IL-4, IL-6, IL-7, epidermal vækstfaktor). De resulterende kimære proteiner eller fusionstoksiner kombinerer cytokinets receptorbindingsspecificitet med toksinets transmembrane og katalytiske domæner. I hvert tilfælde blev det vist, at fusionstoksinerne selektivt kun forgifter de celler, der bærer den tilsvarende målreceptor. Det første af disse genetisk modificerede fusionstoksiner, DAB 389IL-2, evalueres i øjeblikket i kliniske forsøg på mennesker til behandling af refraktære lymfomer og autoimmune sygdomme, hvor celler med IL-2-receptorer med høj affinitet spiller en vigtig rolle i patogenesen.[ 7 ] Administration af DAB 389 IL-2 har vist sig at være sikkert, veltolereret og i stand til at fremkalde varig sygdomsremission uden alvorlige bivirkninger. Det er sandsynligt, at fusionstoksiner baseret på difteritoksin vil blive vigtige nye biologiske midler til behandling af specifikke tumorer eller sygdomme, hvor specifikke celleoverfladereceptorer kan målrettes.


 [
[