Medicinsk ekspert af artiklen
Nye publikationer
Vanemæssig abort - årsager
Sidst revideret: 04.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
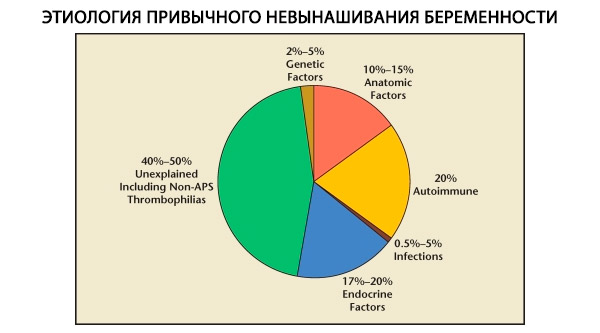
I strukturen af habituelle graviditetstab skelnes der mellem genetiske, anatomiske, endokrine, immunologiske og infektiøse faktorer. Når alle ovenstående årsager udelukkes, er der en gruppe patienter tilbage, hvor oprindelsen af habituelle aborter er uklar (idiopatiske aborter). Ifølge C. Coulam et al. (1996) er 80% af idiopatiske aborter baseret på uopdagede immunforstyrrelser.
Der er ingen overbevisende beviser for, at endometriose forårsager tilbagevendende abort, eller at medicinsk eller kirurgisk behandling af endometriose reducerer forekomsten af tilbagevendende abort.
Ifølge nuværende koncepter består implementeringen af den skadelige effekt af andre faktorer (anatomiske, endokrine, immunologiske) udover genetiske og delvist infektiøse årsager, der fører til dannelsen af et unormalt embryo, i at skabe en ugunstig baggrund for udviklingen af et genetisk komplet befrugtet æg, hvilket fører til udtømning af chorions reservekapacitet og ophør af udvikling (embryogenese). Kritiske perioder i graviditetens første trimester er anerkendt som 6-8 uger (embryoets død) og 10-12 uger (udstødning af det befrugtede æg).
 [ 1 ]
[ 1 ]
Genetiske årsager til sædvanlig spontan abort
Genetiske faktorer tegner sig for 3-6% af årsagerne til habesøgende spontan abort. Ved sporadisk abort i første trimester har omkring 50% af aborterne kromosomafvigelser. De fleste af dem (95%) er ændringer i antallet af kromosomer - monosomi (tab af et kromosom), trisomi (tilstedeværelsen af et ekstra kromosom), som er resultatet af fejl i meiosen, samt polyploidi (en stigning i kromosomsammensætningen med et fuldt haploidt sæt), som opstår, når et æg befrugtes af to eller flere sædceller. Ved sporadiske spontane aborter ses trisomi oftest - 60% af alle mutationer (oftest på kromosom 16, såvel som 13, 18, 21, 22), på andenpladsen i hyppighed er Shereshevsky-Turner syndrom (kromosom 45 X0) - 20%, de resterende 15% skyldes polyploidi (især triploidi).
I tilfælde af en ændring i antallet af kromosomer ved en abort afslører undersøgelsen af forældrenes karyotype oftest ingen patologi, og sandsynligheden for en kromosomal sygdom hos fosteret under en efterfølgende graviditet er 1%. I modsætning hertil observeres strukturelle ændringer i kromosomer (intra- og interkromosomale) i 3-6% af tilfældene ved undersøgelse af aborter hos par med habituel spontan abort. Ved undersøgelse af forældrenes karyotype findes afbalancerede kromosomale omlejringer i 7% af tilfældene. Oftest er der tale om reciprokke translokationer, hvor et segment af et kromosom er placeret på stedet for et andet segment af et ikke-homologt kromosom, samt mosaicisme af kønskromosomer, inversion og detektion af kromosomer i form af en ring. I tilfælde af sådanne omlejringer hos en af ægtefællerne hæmmes processerne for parring og separation af kromosomer under meiose, hvilket resulterer i tab (deletion) eller fordobling (duplikering) af kromosomsektioner i gameterne. Dette resulterer i såkaldte ubalancerede kromosomale omlejringer, hvor embryoet enten er ikke-levedygtigt eller bærer en alvorlig kromosomal patologi. Sandsynligheden for at få et barn med ubalancerede kromosomale abnormiteter i nærvær af balancerede kromosomale omlejringer i den ene forældres karyotype er 1-15%. Forskelle i data er forbundet med omlejringernes art, størrelsen af de involverede segmenter, bærerens køn og familiens historie.
Diagnostik
Anamnese
- Arvelige sygdomme hos familiemedlemmer.
- Tilstedeværelsen af medfødte anomalier i familien.
- Fødsel af børn med mental retardering.
- Tilstedeværelsen af infertilitet og/eller spontan abort af ukendt oprindelse hos et ægtepar eller hos slægtninge.
- Tilstedeværelse af uklare tilfælde af perinatal dødelighed.
Særlige forskningsmetoder
- En undersøgelse af forældrenes karyotype er især indiceret for ægtepar ved fødslen af en nyfødt med udviklingsdefekter ud over en historie med spontan abort, samt i tilfælde af habituelle spontanabort i de tidlige stadier af graviditeten.
- Cytogenetisk analyse af abort i tilfælde af dødfødsel eller neonatal dødelighed.
Indikationer for konsultation med andre specialister
Hvis der opdages ændringer i karyotypen hos forældrene, er en konsultation med en genetiker nødvendig for at vurdere graden af risiko for at få et barn med en patologi eller om nødvendigt at afgøre spørgsmålet om at donere et æg eller en sædcelle.
Videre behandling af patienten
Hvis et ægtepar har en patologisk karyotype, selv hos en af forældrene, anbefales det at udføre prænatal diagnostik under graviditeten - korionbiopsi eller fostervandsprøve - på grund af den høje risiko for udviklingsforstyrrelser hos fosteret.
Anatomiske årsager til habituel abort
Anatomiske årsager til habituel abort inkluderer:
- medfødte anomalier i livmoderudviklingen (fuldstændig fordobling af livmoderen; bihornet, sadelformet, enhjørningsformet livmoder; delvis eller fuldstændig intrauterin septum);
- erhvervede anatomiske defekter;
- intrauterine adhæsioner (Ashermans syndrom);
- submukøse livmoderfibromer;
- isthmisk-cervikal insufficiens.
Hyppigheden af anatomiske anomalier hos patienter med habituel abort varierer fra 10 til 16%. Hyppigheden af forekomst af uterusmisdannelser, der kan resultere i abort (men ikke infertilitet), i forhold til alle uterusmisdannelser er som følger: bihornet livmoder - 37%, sadelformet livmoder - 15%, intrauterin septum - 22%, fuldstændig fordobling af livmoderen - 11%, enhjørningsformet livmoder - 4,4%.
Diagnose af habituel abort
Anamnese
I tilfælde af livmoderens anatomiske patologi observeres sene graviditetsafbrydelser og for tidlig fødsel oftere, men ved implantation på den intrauterine septum eller nær den myomatiske knude er tidlige graviditetsafbrydelser også mulige.
Ved isthmisk-cervikal insufficiens er det patognomoniske tegn spontan afbrydelse af graviditeten i andet trimester eller tidlig for tidlig fødsel, som sker relativt hurtigt og med minimal smerte.
I tilfælde af misdannelser i livmoderen er det nødvendigt at være opmærksom på anamnestiske indikationer på urinvejspatologi (ofte ledsagende medfødte anomalier i livmoderen) og arten af udviklingen af menstruationsfunktionen (indikationer på hæmatometra med et fungerende rudimentært horn i livmoderen).
Særlige undersøgelsesmetoder
- I øjeblikket udføres hysterosalpingografi for at stille en diagnose, der gør det muligt at studere livmoderhulens form, identificere tilstedeværelsen af submukøse fibromer, adhæsioner, skillevægge og bestemme æggeledernes gennemtrængelighed. For at diagnosticere livmoderpatologi er det rationelt at udføre hysterosalpingografi i perioden mellem menstruation og ægløsning, dvs. i den første fase af menstruationscyklussen efter ophør af blodig udflåd (7.-9. dag i cyklussen). For at diagnosticere isthmisk-cervikal insufficiens udføres undersøgelsen i den anden fase af menstruationscyklussen (18.-20. dag) for at bestemme tilstanden af livmoderhalsens indre ost. Før hysterosalpingografi udføres, er det nødvendigt at udelukke inflammatoriske sygdomme i bækkenorganerne eller behandle dem.
- Hysteroskopi er blevet udbredt i de senere år og er blevet guldstandarden til diagnosticering af intrauterin patologi. På grund af dens højere omkostninger sammenlignet med hysterosalpingografi anvendes metoden dog til kvinder med indikation af intrauterin patologi baseret på foreløbige ultralydsdata. Hysteroskopi kan bruges til at undersøge livmoderhulen, bestemme arten af den intrauterine patologi og, hvis det nødvendige udstyr (resektoskop) er tilgængeligt, udføre minimalt invasiv kirurgisk behandling - fjernelse af adhæsioner, submukøse myomknuder og endometriepolypper. Ved fjernelse af en intrauterin septum foretrækkes hysteroresektoskopi med laparoskopisk kontrol, hvilket forhindrer muligheden for perforation af livmodervæggen.
- Ultralyd udføres i den første fase af menstruationscyklussen, hvilket muliggør en formodet diagnose af submukøs uterin myom, intrauterine adhæsioner, og i den anden fase af cyklussen - for at identificere en intrauterin septum og en bicornuat uterus. Denne metode er særlig vigtig i de tidlige stadier af graviditeten, når dens følsomhed i diagnosticeringen af disse tilstande er 100%, og dens specificitet er 80%. Uden for graviditet kræver diagnosen yderligere bekræftelse med andre metoder.
- Udenlandske forfattere påpeger fordelen ved sonohysterografi (ultralyd med en transvaginal sensor med forudgående indføring af en 0,9% natriumchloridopløsning i livmoderhulen) i forhold til hysterosalpingografi, da det muliggør differentialdiagnostik mellem den intrauterine septum og den bihornede livmoder. Med sonohysterografi er det ikke kun muligt at studere formen af livmoderhulen, men også at bestemme konfigurationen af livmoderfundus. I vores land er denne metode ikke blevet udbredt.
- I nogle komplekse tilfælde anvendes MR-scanning af bækkenorganerne til at bekræfte diagnosen. Metoden giver mulighed for at indhente værdifuld information i tilfælde af udviklingsanomalier i livmoderen ledsaget af atypisk organarrangement i bækkenet. MR-scanning er vigtig i tilfælde af et rudimentært livmoderhorn for at afgøre, om det er tilrådeligt at fjerne det. Behovet for at fjerne det rudimentære livmoderhorn opstår, hvis det er forbundet med æggelederen og æggestokken for at forhindre dannelse og udvikling af det befrugtede æg i det. Graviditetsafbrydelse i tilfælde af anatomiske anomalier i livmoderen kan være forbundet med mislykket implantation af det befrugtede æg (på den intrauterine septum, nær den submukøse myomknude), utilstrækkeligt udviklet vaskularisering og modtagelse af endometriet, tætte rumlige relationer i livmoderhulen (for eksempel i tilfælde af hulrumsdeformation af en myomknude), ofte ledsaget af ICI, og hormonelle forstyrrelser.
Behandling af sædvanlig spontan abort
Kirurgisk behandling
Ved tilstedeværelse af en intrauterin septum, submukøse myomknuder og adhæsioner er den mest effektive kirurgiske behandling hysteroresektoskopi. Hyppigheden af efterfølgende aborter i denne gruppe kvinder efter behandling er 10% sammenlignet med 90% før operationen. Ved sammenligning af resultaterne af metroplastik udført ved laparotomi og transcervikal hysteroresektoskopi opnåede P. Heinonen (1997) resultater, der indikerer mindre traume og større effektivitet af hysteroresektoskopi; procentdelen af graviditeter, der resulterede i fødsel af levedygtige børn, var henholdsvis 68 og 86%.
Kirurgisk fjernelse af den intrauterine septum, adhæsioner og submukøse myomknuder udelukker spontan abort i 70-80% af tilfældene. Det er dog ineffektivt hos kvinder med uterine misdannelser, der har haft normale fødsler med efterfølgende tilbagevendende aborter. Det er sandsynligt, at den anatomiske faktor i sådanne tilfælde ikke er den primære årsag, og det er nødvendigt at søge efter andre årsager til spontan abort.
Det er blevet bevist, at abdominal metroplastik er forbundet med en betydelig risiko for postoperativ infertilitet og ikke forbedrer prognosen for efterfølgende graviditeter. Derfor er det bedre at foretrække hysteroskopi og laparoskopiske operationer.
Lægemiddelbehandling
Effektiviteten af indførelsen af spiralen, høje doser østrogene lægemidler, indførelsen af et Foley-kateter i livmoderhulen efter operationer for at fjerne sammenvoksninger og intrauterin septum er ikke blevet bevist. Det anbefales at planlægge graviditet tidligst 3 måneder efter operationen. For at forbedre endometriets vækst udføres cyklisk hormonbehandling i 3 menstruationscyklusser [14]. I 3 måneder i de første 14 dage af cyklussen anbefales det at tage et lægemiddel indeholdende 2 mg 17-beta-østradiol, i de næste 14 dage - 2 mg 17-beta-østradiol og 20 mg dydrogesteron (10 mg dydrogesteron som en del af et kombinationslægemiddel plus 10 mg dydrogesteron i en separat tabletform).
Videre behandling af patienten
Funktioner ved graviditetsforløbet med en bicornuat livmoder eller fordobling af livmoderen (når der er 2 livmoderhulrum):
- I de tidlige stadier af graviditeten forekommer blødning ofte fra det "tomme" horn eller livmoderhulen på grund af en udtalt decidual reaktion; taktikken i dette tilfælde bør være konservativ og bestå af brugen af antispasmodiske og hæmostatiske midler;
- trussel om graviditetsafbrydelse på forskellige stadier;
- udvikling af istmisk-cervikal insufficiens;
- intrauterin væksthæmning på grund af placentainsufficiens.
I de tidlige stadier af graviditeten, i tilfælde af blødning, tilrådes sengeleje og delvis sengeleje, samt administration af hæmostatiske, antispasmodiske og beroligende lægemidler og behandling med gestagener (dydrogesteron i en daglig dosis på 20 til 40 mg) op til 16-18 ugers graviditet.
Endokrine årsager til sædvanlig spontan abort
Ifølge forskellige forfattere tegner endokrine årsager til spontan abort sig for 8 til 20 %. De mest betydningsfulde af disse er lutealfasedefekt (LPD), hypersekretion af LH, skjoldbruskkirteldysfunktion og diabetes mellitus.
Alvorlig sygdom i skjoldbruskkirtlen eller diabetes mellitus kan føre til gentagne aborter. Ved kompenseret diabetes mellitus adskiller risikoen for habituelle aborter sig dog ikke fra den generelle befolkning.
Samtidig kræver den høje forekomst af hypothyroidisme i befolkningen screening med måling af TSH-niveauer. Hos patienter med habetidig spontan abort observeres lutealfaseinsufficiens i 20-60% af tilfældene, og ultralydstegn på polycystiske ovarier - i 44-56%. Ifølge litteraturen er indflydelsen af individuelle hormonelle forstyrrelser på dannelsen af symptomkomplekset ved habetidig spontan abort fortsat kontroversiel. Undersøgelserne af M. Ogasawara et al. (1997) afslørede ikke pålidelige forskelle i hyppigheden af graviditetsafbrydelse med og uden LPI hos patienter med to eller flere tidligere spontane aborter i anamnesen, eksklusive autoimmune, anatomiske og infektiøse årsager.
Utilstrækkelig funktion af corpus luteum kan skyldes en række ugunstige faktorer:
- forstyrrelser i udskillelsen af FSH og LH i den første fase af menstruationscyklussen;
- tidlig eller omvendt for sen top af LH-frigivelse;
- hypoøstrogenisme som følge af utilstrækkelig follikulogenese. Alle disse tilstande kan ikke korrigeres ved erstatningsterapi med gestagenlægemidler i den postovulatoriske periode. Prospektive undersøgelser udført af L. Regan et al. viste en signifikant stigning i hyppigheden af aborter hos patienter med LH-hypersekretion på den 8. dag i menstruationscyklussen sammenlignet med kvinder med normale LH-niveauer i blodet (henholdsvis 65 % og 12 % af aborterne). Den skadelige virkning af en utidig stigning i LH er forbundet med for tidlig genoptagelse af den anden meiotiske deling og ægløsning af et umodent æg, samt med induktion af androgenproduktion af thecaceller sammen med nedsat endometrieoptagelse under påvirkning af gestageninsufficiens. Imidlertid giver en foreløbig reduktion af præovulatoriske LH-niveauer med gonadotropinfrigivende hormonagonister uden yderligere foranstaltninger, der sigter mod at forlænge den efterfølgende graviditet, ikke den forventede reduktion i hyppigheden af aborter.
Guldstandarden til diagnosticering af NLF er histologisk undersøgelse af materiale opnået fra endometriebiopsi i anden fase af cyklussen over 2 menstruationscyklusser.
Diagnose af andre årsager til ovulatorisk dysfunktion, såsom hyperprolaktinæmi, hypothyroidisme, funktionelt overskud af androgener (ovarie eller binyre), skal ledsages af ordination af passende behandling.
Diagnostik
Historie og fysisk undersøgelse
- Anamnese. Faktorer at overveje: sen menarche, uregelmæssig menstruationscyklus (oligomenoré, amenoré, pludselig vægtøgning, vægttab, infertilitet, sædvanlige tidlige aborter).
- Undersøgelse: kropstype, højde, kropsvægt, hirsutisme, sværhedsgraden af sekundære kønskarakteristika, tilstedeværelsen af striae, undersøgelse af mælkekirtler for galaktoré.
- Funktionelle diagnostiske tests: måling af rektaltemperatur i løbet af 3 menstruationscyklusser.
Særlige forskningsmetoder
- Hormonel undersøgelse:
- i den første fase af menstruationscyklussen (7.-8. dag) – bestemmelse af indholdet af FSH, LH, prolaktin, TSH, testosteron, 17-hydroxyprogesteron (17-OP), DHEAS;
- i 2. fase af menstruationscyklussen (21-22 dage) – bestemmelse af progesteronindhold (normative indikatorer for progesteronniveauer er meget variable, metoden kan ikke anvendes uden at tage hensyn til andre faktorer).
- Ultralyd:
- i den første fase af menstruationscyklussen (5.-7. dag) – diagnose af endometriepatologi, polycystiske æggestokke;
- i 2. fase af menstruationscyklussen (20-21 dage) – måling af endometriums tykkelse (normal 10-11 mm, korrelerer med indholdet af progesteron).
- En endometriebiopsi for at verificere NLF udføres 2 dage før den forventede menstruation (på den 26. dag med en 28-dages cyklus). Denne metode anvendes i tilfælde, hvor diagnosen er uklar. For at undersøge ændringer i endometriet i den såkaldte "implantationsvindue"-periode udføres en biopsi på den 6. dag efter ægløsning.
Behandling
Ved diagnosticering af NLF (ifølge rektaltemperaturdiagrammer er varigheden af 2. fase mindre end 11 dage, der observeres en trinvis temperaturstigning, utilstrækkelig sekretorisk transformation af endometriet ifølge endometriebiopsidata, lave niveauer af progesteron i blodserumet) er det nødvendigt at identificere årsagen til sådanne lidelser.
Hvis NLF ledsages af hyperprolaktinæmi, udføres MR-scanning af hjernen. En alternativ metode er røntgenbillede af kraniet (sella turcica-regionen).
Det første stadie i hyperprolaktinæmi er at udelukke hypofyseadenom, hvilket kræver kirurgisk behandling. I mangel af signifikante ændringer betragtes hyperprolaktinæmi som funktionel, og bromocriptinbehandling ordineres for at normalisere prolaktinniveauet. Den initiale dosis bromocriptin er 1,25 mg/dag i 2 uger, og efter overvågning af prolaktinniveauet øges dosis til 2,5 mg/dag, hvis indikatorerne ikke normaliseres. Ved en signifikant stigning i prolaktinniveauet er den initiale dosis 2,5 mg/dag. Hvis graviditet opstår, bør bromocriptin seponeres.
Hvis der påvises hypothyroidisme, bestemmes arten af skjoldbruskkirtelpatologien sammen med en endokrinolog. Under alle omstændigheder er daglig natriumlevothyroxinbehandling indiceret, og dosis vælges individuelt, indtil TSH-niveauet er normaliseret. Hvis graviditet opstår, bør behandlingen med natriumlevothyroxin fortsættes. Spørgsmålet om, hvorvidt det er tilrådeligt at øge dosis i første trimester af graviditeten, afgøres sammen med en endokrinolog efter at have modtaget resultaterne af en hormonel undersøgelse (TSH-niveau, frit thyroxin).
Korrektion af NLF udføres på en af to måder. Den første metode er ægløsningsstimulation, den anden metode er erstatningsterapi med progesteronpræparater.
Den første behandlingsmulighed er ægløsningsstimulation med clomifencitrat. Denne behandlingsmetode er baseret på, at de fleste lutealfaseforstyrrelser opstår i follikulærfasen af cyklussen. Konstant reducerede progesteronniveauer i 2. fase er en konsekvens af nedsat follikulogenese i 1. fase af cyklussen. Denne lidelse vil med større succes blive korrigeret ved lave doser clomifencitrat i den tidlige follikulærfase end ved at ordinere progesteron i 2. fase af cyklussen.
I den 1. cyklus er dosis af clomifencitrat 50 mg/dag fra den 5. til den 9. dag i menstruationscyklussen. Effektiviteten overvåges ved hjælp af rektaltemperaturkurver, progesteronniveaumålinger i cyklussens 2. fase eller dynamisk ultralyd. Hvis der ikke er tilstrækkelig effekt i den 2. cyklus af ægløsningsstimulation, bør dosis af clomifencitrat øges til 100 mg/dag fra den 5. til den 9. dag i cyklussen. Den maksimalt mulige dosis i den 3. cyklus af ægløsningsstimulation er 150 mg/dag. En sådan dosisforøgelse er kun mulig, hvis lægemidlet tolereres godt (ingen intense smerter i underlivet og lænden og ingen andre tegn på ovariel hyperstimulation).
Den anden behandlingsmulighed: erstatningsterapi med progesteronpræparater, som fremmer fuld sekretorisk transformation af endometriet, hvilket giver den nødvendige effekt hos patienter med habegynderaborter med bevaret ægløsning. Derudover er det i de senere år blevet fastslået, at administration af progesteronpræparater ikke kun har en hormonel, men også en immunmodulerende effekt, der undertrykker afstødningsreaktioner fra immunkompetente celler i endometriet. Især er en lignende effekt blevet beskrevet for dihydrogesteron i en dosis på 20 mg/dag. Med henblik på erstatningsterapi anvendes dydrogesteron i en dosis på 20 mg/dag oralt eller mikroniseret progesteron vaginalt i en dosis på 200 mg/dag. Behandlingen udføres på 2. dagen efter ægløsning (dagen efter stigningen i rektal temperatur) og fortsætter i 10 dage. Hvis graviditet opstår, bør behandlingen med progesteronpræparater fortsættes.
Moderne forskning har ikke bekræftet effektiviteten af humant choriongonadotropin i behandlingen af tilbagevendende abort.
Ved hyperandrogenisme (ovarie- eller binyrebarkgener) hos patienter med habituel spontan abort er lægemiddelbehandling indiceret på grund af androgeners effekt på fuldstændigheden af ægløsning og endometriets tilstand. I tilfælde af en forstyrrelse af biosyntesen af binyreandrogener er deres viriliserende effekt på det kvindelige foster mulig, derfor udføres steroidbehandling i fosterets interesse.
Hyperandrogenisme af ovarieoprindelse (polycystiske ovarier)
Anamnese, fysisk undersøgelse og resultater af specialundersøgelser
- Anamnese: sen menarche, menstruationsforstyrrelser såsom oligomenoré (normalt primær, sjældnere sekundær). Graviditeter er sjældne, normalt spontant afbrudt i første trimester, med lange perioder med infertilitet mellem graviditeterne.
- Undersøgelse: hirsutisme, akne, strækmærker, højt kropsmasseindeks (valgfrit).
- Rektale temperaturdiagrammer: anovulatoriske cyklusser veksler med cyklusser med ægløsning og ikke-leverkræft.
- Hormonundersøgelse: høje testosteronniveauer, FSH- og LH-niveauer kan være forhøjede, LH/FSH-forholdet er større end 3. Ultralyd: polycystiske ovarier.
Behandling
Ikke-medicinsk behandling
Vægttab - diætbehandling, fysisk aktivitet.
Lægemiddelbehandling
- Orlistat i en dosis på 120 mg til hvert hovedmåltid. Behandlingsvarigheden bestemmes under hensyntagen til effekt og tolerabilitet.
- Foreløbig testosteronreduktion med præparater indeholdende cyproteronacetat (2 mg) og EE (35 mcg) i 3 menstruationscyklusser.
- Præventionsseponering, hormonel støtte til anden fase af cyklussen (gestagenbehandling) - dydrogesteron i en dosis på 20 mg/dag fra den 16. til den 25. dag i menstruationscyklussen. Hvis der ikke er spontan ægløsning, fortsæt til næste trin.
- Stimulering af ægløsning med clomifencitrat i en initialdosis på 50 mg/dag fra 5. til 9. dag i menstruationscyklussen med samtidig behandling med gestagener (dydrogesteron i en dosis på 20 mg/dag fra 16. til 25. dag i cyklussen) og dexamethason (0,5 mg).
- I mangel af graviditet øges dosis af clomifencitrat til 100-150 mg/dag med administration af gestagener i anden fase af cyklussen og dexamethason (0,5 mg). Det er blevet fastslået, at selvom dexamethason kun reducerer niveauet af binyreandrogener, forekommer ægløsning og befrugtning signifikant oftere ved behandling med clomifencitrat og dexamethason end ved brug af clomifencitrat alene [12].
- Der udføres tre cyklusser med ægløsningsstimulation, hvorefter der anbefales en pause i tre menstruationscyklusser med gestagen støtte og en beslutning om kirurgisk behandling ved hjælp af laparoskopisk adgang (kileresektion af æggestokkene, laserfordampning).
Videre behandling af patienten
Graviditetsbehandling bør ledsages af gestagenisk støtte op til 16 uger af graviditeten (dydrogesteron i en dosis på 20 mg/dag eller mikroniseret progesteron i en dosis på 200 mg/dag). Dexamethason ordineres kun i første trimester af graviditeten. Overvågning er obligatorisk for rettidig diagnose af istmisk-cervikal insufficiens og om nødvendigt kirurgisk korrektion heraf.
Adrenal hyperandrogenisme (pubertal og postpubertal adrenogenital syndrom)
Adrenogenital syndrom (AGS) er en arvelig sygdom forbundet med en forstyrrelse i syntesen af hormoner i binyrebarken på grund af skade på gener, der er ansvarlige for syntesen af en række enzymsystemer. Sygdommen nedarves autosomalt recessivt med overførsel af mutante gener fra begge forældre, som er raske bærere.
I 90% af tilfældene er adrenogenital syndrom forårsaget af mutationer i CYP21B-genet, hvilket fører til en forstyrrelse i syntesen af 21-hydroxylase.
Anamnese, fysisk undersøgelse og resultater af specialundersøgelser
- Anamnese: sen menarche, let forlænget menstruationscyklus, mulig oligomenoré, spontan abort i første trimester, mulig infertilitet.
- Undersøgelse: akne, hirsutisme, android kropstype (brede skuldre, smalt bækken), klitorishypertrofi.
- Rektale temperaturdiagrammer: anovulatoriske cyklusser veksler med cyklusser med ægløsning og ikke-leverkræft.
- Hormonel test: høje niveauer af 17-OP, DHEAS.
- Ultralyd: æggestokkene er uændrede.
Et patognomonisk tegn uden for graviditet er en stigning i koncentrationen af 17-OP i blodplasmaet.
I øjeblikket anvendes en test med ACTH til at diagnosticere den latente, ikke-klassiske form for adrenal hyperandrogenisme. Til denne test anvendes Synacthen - et syntetisk polypeptid, der har egenskaberne ved endogen ACTH, dvs. det stimulerer de indledende faser af syntesen af steroidhormoner fra kolesterol i binyrerne.
Synacthen-test (en ACTH-analog): 1 ml (0,5 mg) synacthen injiceres subkutant i skulderen, og det oprindelige indhold af 17-OP og kortisol bestemmes først i en 9-timers blodplasmaprøve om morgenen. En kontrolblodprøve tages 9 timer efter injektionen for at bestemme niveauet af 17-OP og kortisol. Bestemmelsesindekset (D) beregnes derefter ved hjælp af formlen:
D = 0,052 × 17-OP + 0,005 × Cortisol/17-OP - 0,018 × Cortisol/17-OP
Hvis D-koefficienten er mindre end eller lig med 0,069, indikerer dette fravær af adrenal hyperandrogenisme. Hvis D-koefficienten er mere end 0,069, bør det overvejes, at hyperandrogenisme skyldes en dysfunktion i binyrerne.
Lægemiddelbehandling
Hovedbehandlingen for hyperandrogenisme på grund af 21-hydroxylase-mangel er glukokortikoider, som bruges til at undertrykke overskydende androgensekretion.
Videre behandling af patienten
På grund af den viriliserende effekt af moderens androgener på fosteret, ordineres behandling med dexamethason i en initialdosis på 0,25 mg før graviditet med en etableret diagnose af adrenal hyperandrogenisme, og behandlingen fortsættes med en individuelt valgt dosis (fra 0,5 til 1 mg) under hele graviditeten. Hos en kvinde med habituel spontan abort, der lider af adrenal hyperandrogenisme, er det uhensigtsmæssigt at afbryde behandlingen, da hyppigheden af spontan abort uden behandling når 14%, med fortsættelse - 9%.
I betragtning af at patienter med adrenogenitalt syndrom kan overføre dette gen til fosteret, er det nødvendigt at udføre prænatal diagnostik: i 17-18 uger af graviditeten ordineres en blodprøve for at bestemme moderens indhold af 17-OP. Hvis hormonniveauet i blodet er forhøjet, bestemmes dets koncentration i fostervandet. Hvis indholdet af 17-OP i fostervandet er forhøjet, diagnosticeres adrenogenitalt syndrom hos fosteret. Desværre er det umuligt at bestemme sværhedsgraden af adrenogenitalt syndrom (mild eller saltspildende alvorlig form) ud fra niveauet af 17-OP i fostervandet. Spørgsmålet om at opretholde graviditeten i denne situation afgøres af forældrene.
Hvis barnets far er bærer af adrenogenitalt syndrom-genet, og der har været tilfælde af børn født med dette syndrom i familien, modtager patienten, selv uden adrenal hyperandrogenisme, dexamethason i fosterets interesse (for at forhindre virilisering af det kvindelige foster) i en dosis på 20 mcg/kg kropsvægt, maksimalt 1,5 mg/dag fordelt på 2-3 doser efter måltider. I uge 17-18, efter at fosterets køn og ekspressionen af adrenogenitalt syndrom-genet er fastlagt (baseret på resultaterne af fostervandsprøve), fortsættes behandlingen indtil graviditetens afslutning, hvis fosteret er en pige med adrenogenitalt syndrom. Hvis fosteret er en dreng eller en pige, der ikke er bærer af adrenogenitalt syndrom-genet, kan dexamethason seponeres.
Hvis en kvinde med habituel spontan abort lider af binyrehyperandrogenisme, udføres dexamethasonbehandling under hele graviditeten og ophører først efter fødslen. På den 3. dag efter fødslen reduceres dexamethason-dosis gradvist (med 0,125 mg hver 3. dag) indtil fuldstændig ophør i postpartumperioden.
Hyperandrogenisme af blandet genese (ovarie og binyre)
Anamnese, fysisk undersøgelse og resultater af specialundersøgelser
- Anamnese: sen menarche, menstruationsforstyrrelser såsom oligomenoré (normalt primær, sjældnere sekundær), amenoré, mulige skader, hjernerystelse. Graviditeter er sjældne, normalt spontant afbrudt i første trimester, lange perioder med infertilitet mellem graviditeterne.
- Fysisk undersøgelse: hirsutisme, akne, striae, acanthosis nigricans, højt kropsmasseindeks, hypertension.
- Rektale temperaturdiagrammer: anovulatoriske cyklusser veksler med cyklusser med ægløsning og ikke-leverkræft.
- Hormonundersøgelse: høje testosteronniveauer, FSH- og LH-niveauer kan være forhøjede, LH/FSH-forhold større end 3, høje DHEAS- og 17-OP-niveauer, hyperprolaktinæmi kan være til stede.
- Ultralyd: polycystiske ovarier.
- Elektroencefalografi: ændringer i hjernens bioelektriske aktivitet.
- Hyperinsulinæmi, lipidmetabolismeforstyrrelser (højt kolesteroltal, lipoproteiner med lav densitet og lipoproteiner med meget lav densitet), nedsat glukosetolerance eller forhøjede blodglukoseniveauer.
Behandling
Ikke-medicinsk behandling
Vægttab (kaloriefattig kost, fysisk aktivitet).
Lægemiddelbehandling
Den første fase - i nærvær af insulinresistens anbefales det at ordinere metformin i en daglig dosis på 1000-1500 mg for at øge insulinfølsomheden.
Den anden fase - i tilfælde af alvorlige menstruationscyklusforstyrrelser og høje testosteronniveauer anbefales det at ordinere lægemidler med en antiandrogen effekt indeholdende cyproteronacetat (2 mg) og ethinylestradiol (35 mcg) i 3 måneder.
Det tredje trin er stimulering af ægløsning efterfulgt af gestagen støtte (skemaet er beskrevet ovenfor) og indtagelse af dexamethason i en daglig dosis på 0,25-0,5 mg.
I tilfælde af hyperprolaktinæmi og hypothyroidisme bør passende korrektion af lægemidlet udføres i ægløsningsstimulationscyklusser. Hvis graviditet opstår, bør bromocriptin seponeres, og levothyroxin bør fortsættes.
Hvis ægløsningsstimulation er ineffektiv, bør spørgsmålet om ordination af direkte ægløsningsinducerende midler, tilrådeligheden af kirurgisk behandling af polycystiske æggestokke eller in vitro-fertilisering afgøres.
Videre behandling af patienten
Hos patienter med metabolisk syndrom er graviditet ofte kompliceret af arteriel hypertension, nefropati, hyperkoagulation, i forbindelse med hvilke det er nødvendigt at overvåge blodtrykket, hæmostasiogrammer fra de tidlige stadier af graviditeten og korrigere de opståede lidelser (om nødvendigt) med antihypertensive lægemidler, antitrombocytmidler og antikoagulantia. Gestageniske lægemidler ordineres op til 16 uger af graviditeten - didrogesteron i en dosis på 20 mg/dag eller mikroniseret progesteron i en dosis på 200 mg/dag i 2 doser.
Alle kvinder med hyperandrogenisme repræsenterer en risikogruppe for udvikling af istmisk-cervikal insufficiens. Overvågning af livmoderhalsens tilstand bør udføres fra 16. graviditetsuge, om nødvendigt - kirurgisk korrektion af istmisk-cervikal insufficiens.
Immunologiske årsager til habituel abort
Det er i øjeblikket kendt, at omkring 80% af alle tidligere uforklarlige tilfælde af gentagne graviditetstab (efter udelukkelse af genetiske, anatomiske, hormonelle årsager) er forbundet med immunforstyrrelser. Der skelnes mellem autoimmune og alloimmune lidelser, der fører til habesøgende spontan abort.
Ved autoimmune processer bliver immunsystemets eget væv genstand for aggression, dvs. immunresponset rettes mod dets egne antigener. I denne situation lider fosteret sekundært som følge af skader på moderens væv.
Ved alloimmune lidelser er en kvindes immunrespons rettet mod embryonale/føtale antigener, der modtages fra faderen, og som potentielt er fremmede for moderens krop.
Autoimmune lidelser, der oftest ses hos patienter med habesøgende spontan abort, omfatter tilstedeværelsen af antifosfolipid-, antithyroid- og antinukleære autoantistoffer i serum. Det er således blevet fastslået, at 31 % af kvinder med habesøgende spontan abort uden for graviditet har autoantistoffer mod thyroglobulin og thyroidperoxidase (thyroidmikrosomale [thyroidperoxidase] autoantistoffer); i disse tilfælde stiger risikoen for spontan abort i første trimester af graviditeten til 20 %. Ved habesøgende spontan abort indikerer tilstedeværelsen af antinukleære og antithyroid-antistoffer behovet for yderligere undersøgelse for at identificere den autoimmune proces og verificere diagnosen.
Antifosfolipidsyndrom (APS) er fortsat en generelt anerkendt autoimmun tilstand, der fører til embryo-/fosterdød.
Alloimmune lidelser
I øjeblikket omfatter alloimmune processer, der fører til føtal afstødning, tilstedeværelsen af et øget (mere end 3) antal fælles antigener fra det store histokompatibilitetskomplekssystem hos ægtefæller (ofte observeret i blodsbeboede ægteskaber); lave niveauer af blokeringsfaktorer i moderens serum; øgede niveauer af naturlige dræberceller (NK-celler CD56, CD16) i endometriet og moderens perifere blod både uden for og under graviditeten; høje koncentrationsniveauer af en række cytokiner i endometriet og blodserum, især γ-interferon, tumornekrosefaktor a, interleukiner-1 og 2.
I øjeblikket undersøges alloimmune faktorer, der fører til tidlige graviditetstab, og måder at korrigere ovenstående tilstande på. Der er ingen konsensus om behandlingsmetoderne. Ifølge nogle forskere giver aktiv immunisering med donorlymfocytter ikke en signifikant effekt, mens andre forfattere beskriver en signifikant positiv effekt ved sådan immunisering og behandling med immunoglobuliner.
I øjeblikket er progesteron et af de immunmodulerende midler i den tidlige graviditet. Især har undersøgelser bevist dydrogesterons rolle i en daglig dosis på 20 mg hos kvinder med habituel spontan abort i første trimester af graviditeten med et øget niveau af CD56-celler i endometriet.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Genetisk bestemte trombofilier
Følgende former for genetisk bestemte trombofilier betragtes som trombofile tilstande under graviditet, der fører til hatemæssig abort.
- Antitrombin III-mangel.
- Faktor V-mutation (Leiden-mutation).
- Protein C-mangel.
- Protein S-mangel.
- Protrombin-genmutation G20210A.
- Hyperhomocysteinæmi.
Undersøgelse for at identificere sjældne årsager til trombofili er nødvendig i tilfælde, hvor der var:
- familiehistorie - tromboembolisme før 40-årsalderen hos slægtninge;
- pålidelige episoder med venøs og/eller arteriel trombose før 40-årsalderen;
- tilbagevendende trombose hos patienten og nærmeste pårørende;
- tromboemboliske komplikationer under graviditet og efter fødsel ved brug af hormonel prævention;
- gentagne graviditetstab, dødfødsler, intrauterin væksthæmning, placentaabruption;
- tidlig præeklampsi, HELLP-syndrom.
Infektiøse årsager til sædvanlig spontan abort
Den infektiøse faktors rolle som årsag til habetidsabort er i øjeblikket under omfattende debat. Det er kendt, at primær infektion i de tidlige stadier af graviditeten kan forårsage skade på embryoet, der er uforenelig med liv, hvilket fører til sporadisk spontan abort. Sandsynligheden for reaktivering af infektionen samtidig med gentagne graviditetstab er dog ubetydelig. Derudover er der i øjeblikket ikke fundet mikroorganismer, der fremkalder habetidsabort. Undersøgelser i de senere år har vist, at de fleste kvinder med habetidsabort og kronisk endometritis har en prævalens af 2-3 eller flere typer obligate anaerobe mikroorganismer og vira i endometriet.
Ifølge VM Sidelnikova et al. blev diagnosen kronisk endometritis uden for graviditet histologisk verificeret hos kvinder, der led af habituel abort, og i 86,7% blev der observeret persistens af opportunistiske mikroorganismer i endometriet, hvilket med sikkerhed kan være årsagen til aktivering af immunopatologiske processer. Blandet persisterende virusinfektion (herpes simplex-virus, Coxsackie A, Coxsackie B, enterovirus 68-71, cytomegalovirus) findes hos patienter med habituel abort signifikant oftere end hos kvinder med en normal obstetrisk historie. K. Kohut et al. (1997) viste, at procentdelen af inflammatoriske forandringer i endometriet og decidualvævet hos patienter med primær tilbagevendende abort er signifikant højere end hos kvinder efter abort med en historie med mindst én fuldbåren fødsel.
Bakteriel og viral kolonisering af endometriet skyldes normalt immunsystemets og kroppens uspecifikke beskyttende kræfter (komplementsystemet, fagocytose) manglende evne til fuldstændigt at eliminere det infektiøse agens, og samtidig begrænses dets spredning af aktiveringen af T-lymfocytter (T-hjælpere, naturlige dræbere) og makrofager. I alle ovenstående tilfælde forekommer der persistens af mikroorganismer, karakteriseret ved tiltrækning af mononukleære fagocytter, naturlige dræbere, T-hjælpere, der syntetiserer forskellige cytokiner, til stedet for kronisk inflammation. Tilsyneladende forhindrer en sådan tilstand af endometriet dannelsen af lokal immunsuppression i præimplantationsperioden, hvilket er nødvendigt for at danne en beskyttende barriere og forhindre afstødning af et halvfremmed foster.
I denne henseende bør kvinder med habituel spontan abort diagnosticeres med kronisk endometritis før graviditet. For at fastslå eller udelukke denne diagnose udføres en endometriebiopsi på 7.-8. dag i menstruationscyklussen med histologisk undersøgelse, PCR og bakteriologisk undersøgelse af materialet fra livmoderhulen. Ved verificering af diagnosen behandles kronisk endometritis i henhold til standarderne for behandling af inflammatoriske sygdomme i bækkenorganerne.

