Medicinsk ekspert af artiklen
Nye publikationer
Behandling af svær sepsis og septisk chok
Sidst revideret: 04.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Effektiv behandling af sepsis er kun mulig med fuld kirurgisk sanering af infektionsstedet og tilstrækkelig antimikrobiel behandling. Utilstrækkelig initial antimikrobiel behandling er en risikofaktor for død hos patienter med sepsis. Det er kun muligt at bevare patientens liv, forebygge og eliminere organdysfunktioner med målrettet intensiv pleje.
Hovedformålet er at optimere O2- transporten under forhold med øget forbrug, hvilket er typisk for svær sepsis og septisk shock. Denne behandling implementeres gennem hæmodynamisk og respiratorisk støtte.
Hæmodynamisk støtte
Infusionsbehandling
Infusionsbehandling er en af de indledende foranstaltninger til at opretholde hæmodynamik og frem for alt hjertets minutvolumen. Dens primære opgaver hos patienter med sepsis er:
- genoprettelse af tilstrækkelig vævsperfusion,
- korrektion af homeostaseforstyrrelser,
- normalisering af cellulær metabolisme,
- reduktion i koncentrationen af septiske kaskademediatorer og toksiske metabolitter.
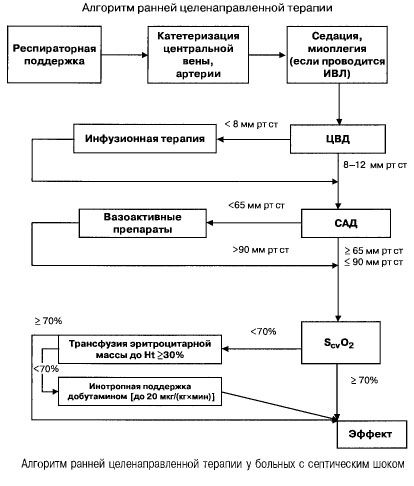
Ved sepsis med multiorgansvigt og septisk shock forsøger man hurtigt (inden for de første 6 timer) at opnå følgende værdier for vigtige indikatorer:
- hæmatokrit >30%,
- diurese 0,5 ml/(kg/h),
- blodmætning i vena cava superior eller højre atrium >70%,
- gennemsnitligt blodtryk >65 mm Hg,
- CVP 8-12 mm Hg
Ved at opretholde disse værdier på det specificerede niveau forbedres patientens overlevelse (evidenskategori B). Hæmodynamisk monitorering ved hjælp af et Swan-Ganz-kateter og PICCO-teknologi (transpulmonal termodilution og pulsbølgeanalyse) udvides mulighederne for at monitorere og vurdere effektiviteten af hæmodynamisk terapi, men der er ingen evidens for, at de forbedrer overlevelsen.
Den optimale forbelastningsværdi vælges individuelt, da det er nødvendigt at tage hensyn til graden af endotelskade og tilstanden af lymfedrænage i lungerne, ventriklernes diastoliske funktion og ændringer i det intrathorakale tryk. Volumen af infusionsbehandling vælges, så PCWP ikke overstiger plasma-COP (forebyggelse af OL), og der er en stigning i CO. Derudover tages der hensyn til parametre, der karakteriserer lungernes gasudvekslingsfunktion (paO2 og paO2 / FiO2 ), og ændringer i det radiografiske billede.
Til infusionsbehandling som en del af den målrettede behandling af sepsis og septisk shock anvendes krystalloide og kolloide opløsninger med stort set identiske resultater.
Alle infusionsmedier har både fordele og ulemper. I dag, givet resultaterne af eksperimentelle og kliniske studier, er der ingen grund til at foretrække en bestemt type.
- For eksempel er det for tilstrækkelig korrektion af venøs tilbageløb og preload-niveau nødvendigt at administrere et volumen af krystalloider, der er 2-4 gange større end kolloidernes, hvilket er forbundet med de særlige forhold ved opløsningens fordeling i kroppen. Derudover er krystalloidinfusion forbundet med en større risiko for vævsødem, og deres hæmodynamiske effekt er kortere end kolloidernes. Samtidig er krystalloider billigere, påvirker ikke koagulationspotentialet og fremkalder ikke anafylaktoide reaktioner. Baseret på ovenstående bestemmes den kvalitative sammensætning af infusionsprogrammet afhængigt af patientens karakteristika, under hensyntagen til graden af hypovolæmi, fasen af DIC-syndrom, tilstedeværelsen af perifert ødem og koncentrationen af albumin i blodserumet, sværhedsgraden af akut lungeskade.
- Plasmasubstitutter (dextraner, gelatinepræparater, hydroxyethylstivelse) er indiceret i tilfælde af alvorlig BCC-mangel. Hydroxyethylstivelser med en substitutionsgrad på 200/0,5, 130/0,4 og 130/0,42 har en potentiel fordel i forhold til dextraner på grund af en lavere risiko for membranudslip og fraværet af en klinisk signifikant effekt på hæmostasen.
- Indgivelse af albumin under kritiske forhold kan øge risikoen for død. Stigningen i COP under infusionen er forbigående, og derefter, under forhold med øget permeabilitet af kapillærlejet ("kapillærlækage"-syndromet), forekommer yderligere ekstravasation af albumin. Det er muligt, at albumintransfusion kun vil være nyttig, hvis dets koncentration i serum er mindre end 20 g/l, og der ikke er tegn på "lækage" i interstitiet.
- Brugen af kryoplasma er indiceret til forbrugskoagulopati og nedsat blodets koagulationspotentiale.
- Den udbredte anvendelse af donorblodlegemer bør begrænses på grund af den høje risiko for at udvikle forskellige komplikationer (APL, anafylaktiske reaktioner osv.). Ifølge de fleste eksperter er den minimale hæmoglobinkoncentration hos patienter med svær sepsis 90-100 g/l.
Korrektion af hypotension
Lavt perfusionstryk kræver øjeblikkelig aktivering af lægemidler, der øger vaskulær tonus og/eller hjertets inotropiske funktion. Dopamin eller noradrenalin er førstelinjelægemidler til korrektion af hypotension hos patienter med septisk shock.
Dopamin (dopmin) i en dosis på <10 mcg/(kg x min) øger blodtrykket, primært ved at øge CO, og har en minimal effekt på den systemiske vaskulære modstand. Ved høje doser dominerer dens α-adrenerge effekt, hvilket fører til arteriel vasokonstriktion, og ved en dosis på <5 mcg/(kg x min) stimulerer dopamin dopaminerge receptorer i nyre-, mesenteriske og koronarkar, hvilket fører til vasodilatation, øget glomerulær filtration og Na+-udskillelse.
Noradrenalin øger det gennemsnitlige arterielle tryk og øger glomerulær filtration. Optimering af systemisk hæmodynamik under dets virkning fører til forbedring af nyrefunktionen uden brug af lave doser dopamin. Studier i de senere år har vist, at dets isolerede brug, sammenlignet med en kombination med høje doser dopamin, fører til et statistisk signifikant fald i dødeligheden.
Adrenalin er et adrenergt lægemiddel med de mest udtalte hæmodynamiske bivirkninger. Det har en dosisafhængig effekt på hjertefrekvens, gennemsnitligt arterielt tryk, hjerteminutvolumen, venstre ventrikelfunktion samt O2-tilførsel og -forbrug . Imidlertid forekommer takyarytmier, forringelse af organblodgennemstrømningen og hyperlaktatæmi samtidigt. Derfor er brugen af adrenalin begrænset til tilfælde af fuldstændig refraktæritet over for andre katekolaminer.
Dobutamin er det foretrukne lægemiddel til at øge CO- og O2-tilførsel og -forbrug ved normal eller forhøjet præload. På grund af dets overvejende virkning på beta1-adrenerge receptorer er det mere effektivt end dopamin til at øge disse parametre.
Eksperimentelle studier har vist, at katekolaminer, udover at understøtte blodcirkulationen, kan regulere forløbet af systemisk inflammation ved at påvirke syntesen af nøglemediatorer med en fjern effekt. Under påvirkning af adrenalin, dopamin, noradrenalin og dobutamin reducerer aktiverede makrofager syntesen og udskillelsen af TNF-α.
Udvælgelsen af adrenerge midler udføres i henhold til følgende algoritme:
- hjerteindeks 3,5-4 l/(min x m² ), SvO² > 70% - dopamin eller noradrenalin,
- hjerteindeks <3,5 l/(min x m² ), SvO2 <70% - dobutamin (hvis systolisk blodtryk <70 mm Hg - sammen med noradrenalin eller dopamin).
 [ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
[ 1 ], [ 2 ], [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ]
Respirationsstøtte
Lungerne er blandt de første målorganer, der er involveret i den patologiske proces ved sepsis. Akut respirationssvigt er en af de vigtigste komponenter i multipel organdysfunktion. Dens kliniske og laboratoriemæssige manifestationer ved sepsis svarer til ALI, og med progressionen af den patologiske proces - ARDS. Indikationer for mekanisk ventilation ved svær sepsis bestemmes afhængigt af sværhedsgraden af parenkymatøst respirationssvigt (ARF eller ARDS). Kriteriet er respirationsindekset:
- <200 - trakeal intubation og respiratorisk støtte er indiceret,
- >200 - aflæsninger bestemmes individuelt.
Hvis patienten er ved bevidsthed under spontan vejrtrækning med iltstøtte, der ikke er stor belastning af vejrtrækningsarbejdet og udtalt takykardi (HR <120 pr. minut), og den normale værdi af venøst tilbageløb SO2 > 90%, er det muligt at undlade at overføre til kunstig ventilation. Det er dog nødvendigt at overvåge patientens tilstand nøje. Den optimale værdi af SO2 er omkring 90%. Den kan opretholdes ved forskellige gastilførselsmetoder (ansigtsmasker, nasale katetre) i ikke-toksiske koncentrationer (FiO2 < 0,6). Ikke-invasiv kunstig ventilation er kontraindiceret ved sepsis (evidenskategori B).
Højvolumen mekanisk ventilation (MVV) (VO = 12 ml/kg) bør undgås, da lungernes udskillelse af cytokiner øges i sådanne tilfælde, hvilket fører til forværring af MOF. Det er nødvendigt at overholde konceptet om sikker mekanisk ventilation, hvilket er muligt, hvis følgende betingelser er opfyldt (evidenskategori A):
- DO <10 ml/kg,
- ikke-inverteret forhold mellem indånding og udånding,
- maksimalt luftvejstryk <35 cm H2O,
- FiO2 < 0,6.
Valget af respirationscyklusparametre udføres, indtil tilstrækkelig mekanisk ventilation er opnået. Kriterierne er paO2 > 60 mm Hg, SpO2 > 88-93 %, pvO2 35-45 mm Hg, SvO2 > 55 %.
En af de effektive metoder til at optimere gasudveksling er at udføre kunstig ventilation i maveleje (Prone Positioning) (evidenskategori B). Denne stilling er effektiv hos patienter i den mest alvorlige tilstand, selvom dens effekt på at reducere dødeligheden på lang sigt er statistisk insignifikant.
Ernæringsstøtte
Kunstig ernæringsstøtte er et vigtigt element i behandlingen, en af de obligatoriske foranstaltninger, da udviklingen af syndromet med multipel organsvigt ved sepsis normalt ledsages af manifestationer af hypermetabolisme. I en sådan situation opfyldes energibehovet ved ødelæggelse af ens egne cellulære strukturer (autokannibalisme), hvilket forværrer organdysfunktion og øger endotoksikose.
Ernæringsstøtte betragtes som en metode til at forebygge alvorlig udmattelse (protein-energimangel) på baggrund af en markant stigning i kata- og metabolisme. Inkludering af enteral ernæring i komplekset med intensiv terapi forhindrer bevægelsen af tarmmikrofloraen, dysbakteriose, øger enterocytternes funktionelle aktivitet og tarmslimhindens beskyttende egenskaber. Disse faktorer reducerer graden af endotoksikose og risikoen for sekundære infektiøse komplikationer.
Beregning af ernæringsmæssig støtte:
- energiværdi - 25-35 kcal/(kg kropsvægt x dag),
- mængde protein - 1,3-2,0 g/(kg kropsvægt x dag),
- mængde kulhydrater (glukose) - mindre end 6 g/kg/dag,
- mængde fedt - 0,5-1 g/kg/dag,
- glutamindipeptider 0,3-0,4 g/kg/dag,
- vitaminer - standard daglig dosis + vitamin K (10 mg/dag) + vitamin B1 og B6 ( 100 mg/dag) + vitamin A, C, E
- mikroelementer - standard daglig dosis + Zn (15-20 mg/dag + 10 mg/dag ved løs afføring),
- elektrolytter - Na+, K+, Ca2+ i henhold til balanceberegninger og koncentration i plasma.
Tidlig påbegyndelse af ernæringsstøtte (24-36 timer) er mere effektiv end på 3.-4. dag af intensiv behandling (evidenskategori B), især ved enteral sondeernæring.
Ved svær sepsis er der ingen fordele ved enteral eller parenteral ernæring; varigheden af organdysfunktion og varigheden af respiratorisk og inotropisk støtte er den samme, og dødeligheden er den samme. I betragtning af ovenstående er tidlig enteral ernæring et billigere alternativ til parenteral ernæring. Brugen af blandinger beriget med kostfibre (præbiotika) til sondeernæring reducerer signifikant forekomsten af diarré hos patienter med svær sepsis.
For effektiv proteinsyntese i kroppen er det vigtigt at opretholde metabolisk forhold "total nitrogen, g - ikke-proteinkalorier, kcal" = 1-(110-130). Den maksimale dosis kulhydrater er 6 g / (kg kropsvægt pr. dag), da indførelsen af store doser truer med hyperglykæmi og aktivering af katabolisme i skeletmuskler. Fedtemulsioner anbefales at administreres døgnet rundt.
Kontraindikationer for ernæringsstøtte:
- dekompenseret metabolisk acidose,
- individuel intolerance over for ernæringsstøttende medier,
- alvorlig uoprettelig hypovolæmi,
- refraktært shock - dopamin dosis >15 mcg/(kg x min) og systolisk blodtryk <90 mm Hg,
- svær, intraktabel arteriel hypoxæmi.
Glykæmisk kontrol
Et vigtigt aspekt ved kompleks behandling af svær sepsis er konstant overvågning af glukosekoncentrationen i blodplasma og insulinbehandling. Høj glykæmi og behovet for korrektion heraf er faktorer, der bidrager til et ugunstigt udfald ved sepsis. Under ovenstående omstændigheder opretholdes normoglykæmi (4,5-6,1 mmol/l) hos patienter, og når glukosekoncentrationen stiger over acceptable værdier, udføres insulininfusion (0,5-1 U/t). Afhængigt af den kliniske situation overvåges glukosekoncentrationen hver 1-4 time. Ved implementering af denne algoritme blev der observeret en statistisk signifikant stigning i patientoverlevelse.
 [ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
[ 9 ], [ 10 ], [ 11 ], [ 12 ], [ 13 ]
Glukokortikoider
Resultaterne af moderne undersøgelser vedrørende effektiviteten af glukokortikoidbrug hos patienter med septisk shock er opsummeret i følgende udsagn:
- Det er uhensigtsmæssigt at anvende hormoner i høje doser [methylprednisolon 30-120 mg/(kg x dag) én gang eller i 9 dage, dexamethason 2 mg/(kg x dag) i 2 dage, betamethason 1 mg/(kg x dag) i 3 dage] - øget risiko for hospitalsinfektioner, ingen effekt på overlevelse,
- Brug af hydrocortison i en dosis på 240-300 mg dagligt i 5-7 dage fremskynder stabiliseringen af hæmodynamiske parametre, muliggør seponering af vaskulær støtte og forbedrer overlevelsen hos patienter med samtidig relativ binyreinsufficiens (evidenskategori B).
Det er nødvendigt at opgive den kaotiske empiriske ordination af prednisolon og dexamethason - der er ingen grund til at ekstrapolere ny information til dem. I mangel af laboratoriebevis for relativ binyreinsufficiens administreres hydrocortison i en dosis på 300 mg dagligt (i 3-6 injektioner).
- i refraktært chok,
- hvis høje doser vasopressorer er nødvendige for at opretholde effektiv hæmodynamik.
Det er muligt, at hydrocortisons effektivitet under systemiske inflammationer i forbindelse med septisk shock er forbundet med aktivering af nuklearfaktor-kB-hæmmeren (NF-kB-a) og korrektion af relativ binyrebarkinsufficiens. Hæmning af aktiviteten af transkriptionsnuklearfaktoren (NF-kB) fører til gengæld til et fald i dannelsen af inducerbar NO-syntetase (NO er den kraftigste endogene vasodilatator), proinflammatoriske cytokiner, COX og adhæsionsmolekyler.
Aktiveret protein C
En af de karakteristiske manifestationer af sepsis er en forstyrrelse af systemisk koagulation (aktivering af koagulationskaskaden og hæmning af fibrinolyse), hvilket i sidste ende fører til hypoperfusion og organdysfunktion. Effekten af aktiveret protein C på det inflammatoriske system realiseres på flere måder:
- reduktion af selektinbinding til leukocytter, hvilket beskytter endotelet mod skade, hvilket spiller en nøglerolle i udviklingen af systemisk inflammation,
- nedsat frigivelse af cytokiner fra monocytter,
- blokering af frigivelsen af TNF-α fra leukocytter,
- hæmning af trombinproduktion (det forstærker den inflammatoriske respons).
Antikoagulerende, profibrinolytisk og antiinflammatorisk virkning
- aktiveret protein C skyldes
- nedbrydning af faktorerne Va og VIIIa - undertrykkelse af trombedannelse,
- undertrykkelse af plasminogenaktivatorinhibitor - aktivering af fibrinolyse,
- direkte antiinflammatorisk effekt på endotelceller og neutrofiler,
- beskyttelse af endotelet mod apoptose
Administration af aktiveret protein C [drotrecogin alfa (aktiveret)] ved 24 mcg/(kg time) i 96 timer reducerer risikoen for død med 19,4%. Indikationer for administration: sepsis med akut MOF og høj risiko for død (APACHE II > 25 point, dysfunktion i 2 eller flere organer, evidenskategori B).
Aktiveret protein C reducerer ikke dødeligheden hos børn, patienter med enkeltorgansvigt, APACHE II < 25 point, hos patienter med ikke-kirurgisk sepsis.
 [ 14 ], [ 15 ], [ 16 ], [ 17 ]
[ 14 ], [ 15 ], [ 16 ], [ 17 ]
Immunglobuliner
Det tilrådelige ved intravenøs administration af immunglobuliner (IgG og IgG+IgM) er forbundet med deres evne til at begrænse den overdrevne virkning af proinflammatoriske cytokiner, øge clearance af endotoksiner og stafylokok-superantigen, eliminere anergi og forstærke effekten af ß-laktam-antibiotika. Deres anvendelse i behandlingen af svær sepsis og septisk shock er den eneste metode til immunkorrektion, der øger overlevelsen. Den bedste effekt blev registreret ved anvendelse af en kombination af IgG og IgM [RR=0,48 (0,35-0,75), evidenskategori A]. Standarddoseringsregimet er 3-5 ml/(kg x dag) i 3 dage i træk. Ved anvendelse af immunglobuliner blev de mest optimale resultater opnået i den tidlige fase af shock ("varmt shock") og hos patienter med svær sepsis (APACHE II-score på 20-25 point).
Forebyggelse af dyb venetrombose
Forebyggelse af DVT i underekstremiteterne påvirker behandlingsresultaterne signifikant hos patienter med sepsis (evidenskategori A). Både ufraktioneret heparin og lavmolekylær heparin anvendes til dette formål. De vigtigste fordele ved lavmolekylære hepariner er en lavere forekomst af hæmoragiske komplikationer, en svagere effekt på trombocytfunktionen og en langvarig effekt (kan administreres én gang dagligt).
Forebyggelse af dannelsen af stresssår i mave-tarmkanalen
Denne retning spiller en væsentlig rolle i et gunstigt resultat i behandlingen af patienter med svær sepsis og septisk shock, da dødeligheden for blødning fra stresssår i mave-tarmkanalen er 64-87%. Uden forebyggende foranstaltninger forekommer stresssår hos 52,8% af kritisk syge patienter. Brugen af protonpumpehæmmere og histamin H2-receptorblokkere reducerer dog risikoen med mere end 2 gange (den første gruppe lægemidler er mere effektiv end den anden). Hovedretningen for forebyggelse og behandling er at opretholde en pH-værdi inden for 3,5-6,0. Det skal understreges, at ud over ovenstående lægemidler spiller enteral ernæring en vigtig rolle i forebyggelsen af dannelsen af stresssår.
Ekstrakorporal blodrensning
Forskellige biologisk aktive stoffer og metaboliske produkter, der er involveret i udviklingen af generaliseret inflammation, er mål for afgiftningsmetoder, hvilket er særligt vigtigt i mangel af naturlig hepatorenal clearance ved tilstande med multiorgansvigt. Metoder til nyreerstatningsterapi anses for lovende, da de ikke kun kan påvirke uræmiske lidelser hos patienter med nyresvigt, men også have en positiv effekt på andre ændringer i homeostase og organdysfunktioner, der opstår ved sepsis, shock og multiorgansvigt.
Der er til dato ingen data, der bekræfter behovet for at anvende ekstrakorporale blodrensningsmetoder som en af hovedretningerne for patogenetisk behandling af sepsis og septisk shock. Deres anvendelse er berettiget i tilfælde af multiorgansvigt med nyredominans.
 [ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
[ 18 ], [ 19 ], [ 20 ], [ 21 ], [ 22 ], [ 23 ]
Hæmodialyse
Metodens essens er diffusion af stoffer med lav molekylvægt (op til 5x10³ Da ) gennem en semipermeabel membran og fjernelse af overskydende væske fra kroppen langs en trykgradient. Hæmodialyse anvendes i vid udstrækning til behandling af patienter med både kronisk og akut nyresvigt. Diffusionshastigheden af stoffer afhænger eksponentielt af deres molekylvægt. For eksempel er fjernelsen af oligopeptider langsommere end deres syntese.
Hæmofiltrering
Hæmofiltrering er en effektiv metode til at fjerne stoffer med en molekylvægt på 5x10³ - 5x10⁴ Da og den eneste måde at fjerne en stor gruppe biologisk aktive stoffer og metabolitter fra kroppen. Metoden er baseret på konvektionsmetoden til masseoverførsel. Ud over tilstrækkelig korrektion af azotæmi fjerner hæmofiltrering effektivt anafylatoksinerne C3a, C5a, proinflammatoriske cytokiner (TNF-a, IL-1b, 6 og 8), ß2-mikroglobulin, myoglobin, parathyroidhormon, lysozym (molekylvægt - 6000 Da), α-amylase (molekylvægt - 36.000-51.000 Da), kreatinphosphokinase, alkalisk fosfatase, transaminaser og andre stoffer. Hæmofiltrering fjerner aminosyrer og plasmaproteiner (inklusive immunoglobuliner og cirkulerende immunkomplekser).
Hæmodiafiltration
Hæmodiafiltrering er den mest effektive metode til blodrensning, der kombinerer diffusion og konvektion (dvs. GD og GF). Et yderligere bidrag til afgiftningsprocessen ydes af sorptionen af patologiske stoffer på filtermembranen.
Plasmaferese
Plasmaferese (plasmaudskiftning, plasmafiltrering) betragtes også som en mulig metode til at korrigere generaliseret inflammation hos patienter med sepsis og septisk shock. Den optimale metode anses for at være kontinuerlig plasmaudskiftning med fjernelse af 3-5 volumener plasma og samtidig erstatning med friskfrosne, albumin-, kolloidale og krystalloide opløsninger. Med en sigtekoefficient på 1 sikrer plasmafiltrering god fjernelse af C-reaktivt protein, haptoglobin, komplementfragment C3, 1-antitrypsin, IL-6, thromboxan-B2, granulocytstimulerende faktor, TNF. Brugen af sorbenter til at rense patientens plasma reducerer risikoen for infektion og reducerer omkostningerne ved proceduren, da der ikke er behov for at bruge fremmede proteiner.
Brug af forlænget infusion af natriumselenit (selenase) 1000 mcg/dag ved svær sepsis fører til et fald i dødeligheden.
Selen er et essentielt mikroelement, hvis betydning er forbundet med dets nøglerolle i cellernes antioxidantsystemer. Selenniveauet i blodet holdes inden for 1,9-3,17 μM/l. Behovet for selen er 50-200 μg pr. dag, og det afhænger af tilgængeligheden af andre antioxidanter og mikroelementer.
Selen er en kraftig antioxidant, en komponent i glutathionperoxidase, phospholin-glutathionperoxidase, andre oxidoreduktaser og nogle transferaser. Glutathionperoxidase er det vigtigste led i det endogene antioxidantsystem.
Selens effektivitet under kritiske forhold er blevet undersøgt i de senere år. Disse undersøgelser har vist, at selens primære virkningsmekanismer er:
- undertrykkelse af NF-kB hyperaktivering;
- nedsat komplementaktivering;
- dets virkning som et immunmodulerende, antioxidant og antiinflammatorisk middel
- opretholdelse af peroxidudnyttelse;
- undertrykkelse af endoteladhæsion (reduceret ekspression af ICAM-1, VCAM-2,
- E - selektin, P - selektin);
- beskyttelse af endotelet mod oxyradikaler (ved hjælp af selenoprotein P, som forhindrer dannelsen af peroxynitrit fra O2 og NO).
For at opsummere ovenstående kan vi definere specifikke opgaver inden for intensiv pleje ved svær sepsis:
- Hæmodynamisk støtte: CVP 8-12 mm Hg, gennemsnitligt blodtryk >65 mm Hg, diurese 0,5 ml/(kg t), hæmatokrit >30%, blandet venøs blodmætning >70%.
- Peak luftvejstryk ved respirationsstøtte <35 cm H2O, inspiratorisk iltfraktion <60 %, tidalvolumen <10 ml/kg, ikke-inverteret inspiratorisk/ekspiratorisk forhold.
- Glukokortikoider - "lave doser" (hydrokortison 240-300 mg pr. dag).
- Aktiveret protein C 24 mcg/(kg time) i 4 dage ved svær sepsis (APACHE II >25).
- Immunkorrigerende erstatningsterapi med pentaglobin.
- Forebyggelse af dyb venetrombose i underekstremiteterne.
- Forebyggelse af dannelsen af stresssår i mave-tarmkanalen: brug af protonpumpehæmmere og H2-histaminreceptorblokkere.
- Erstatningsterapi for akut nyresvigt.
- Næringsindhold: energiværdi af mad 25-30 kcal/kg kropsvægt x dag), protein 1,3-2,0 g/(kg kropsvægt x dag), glutamindipeptider 0,3-0,4 g/(kg x dag), glukose - 30-70 % af ikke-proteinkalorier, forudsat at glykæmien holdes <6,1 mmol/l, fedt - 15-50 % af ikke-proteinkalorier.

