Medicinsk ekspert af artiklen
Nye publikationer
Medicin
Neuroleptika eller antipsykotika
Sidst revideret: 04.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Antipsykotika (neuroleptika) er en klasse af psykotrope lægemidler, der primært anvendes til behandling af skizofreni. I øjeblikket er det almindeligt at skelne mellem to grupper (eller kategorier) af lægemidler: typiske og atypiske antipsykotika. Nedenfor er information om de farmakologiske egenskaber, indikationer for brug og bivirkninger af behandlingen for hver af disse lægemiddelgrupper.
Indikationer for brug af typiske antipsykotika
I øjeblikket omfatter de vigtigste indikationer for ordination af traditionelle neuroleptika, ifølge anbefalinger fra autoritative forskere inden for psykofarmakaterapi, følgende.
- Lindring af psykomotorisk agitation og adfærdsforstyrrelser forårsaget af alvorlige psykotiske symptomer. I disse tilfælde er brugen af orale eller parenterale former for lægemidler med antipsykotisk virkning indiceret, både globale (clopromazin, levomepromazin, thioproperazin, zuclopenthixol) og selektive - i form af en effekt på hallucinatorisk-paranoide lidelser (haloperidol, trifluoperazin).
- Anti-tilbagefaldsbehandling (forebyggende behandling). Til dette formål ordineres depotformer af lægemidler, især til patienter med dårlig lægemiddelcompliance (haloperidoldecanoat, forlænget form af flupentixol), eller små eller mellemstore doser af lægemidler for at opnå en disinhibitorisk (antinegativ) effekt, blandt de lægemidler, hvis høje doser anvendes til at lindre akutte psykotiske lidelser (flupentixol, zuclopenthixol). I denne type behandling anbefales det også at ordinere såkaldte små neuroleptika (thioridazin, chlorprothixen, sulpirid), hvis psykotrope aktivitet består i en effekt på manifestationerne af den depressive pol og søvnløshedsforstyrrelser.
- Overvindelse af terapeutisk resistens over for atypiske antipsykotika i behandlingen af akutte psykotiske tilstande. Til dette formål anvendes normalt parenterale former for traditionelle antipsykotika med global (chlorpromazin, levomepromazin osv.) og selektiv (haloperidol) antipsykotisk virkning.
Disse lægemidler forårsager forskellige bivirkninger, hvis art afhænger af de enkelte lægemidlers farmakologiske profil. Antipsykotika med en mere udtalt kolinolytisk effekt forårsager oftere akkommodationsforstyrrelser, forstoppelse, mundtørhed og urinretention. En beroligende effekt er mere typisk for antipsykotika med en udtalt antihistamineffekt, og ortostatisk hypotension er mere typisk for lægemidler, der blokerer a1-adrenerge receptorer. Blokering af kolinerg, nordrenerg og dopaminerg transmission af typiske neuroleptika kan føre til en række lidelser i den seksuelle sfære, såsom amenoré eller dysmenoré, anorgasmi, galaktoré, hævelse og ømhed i brystkirtlerne og nedsat potens. Bivirkninger i den seksuelle sfære er hovedsageligt forbundet med disse lægemidlers kolinolytiske og adrenoblokerende egenskaber, samt med en stigning i prolaktinsekretion på grund af blokaden af dopaminmetabolismen. De mest alvorlige bivirkninger af typiske neuroleptika er motorisk dysfunktion. De er den mest almindelige årsag til, at patienter stopper med at tage medicin. De tre primære bivirkninger ved behandlingen forbundet med påvirkning af den motoriske sfære omfatter tidlige ekstrapyramidale syndromer, tardiv dyskinesi og malignt neuromuskulært syndrom.
Ekstrapyramidale syndromer menes at være forbundet med blokade af D2-receptorer i basalganglierne. De omfatter dystoni, neuroleptisk parkinsonisme og akatisi. Manifestationer af akut dystonisk reaktion (tidlig dyskinesi) omfatter pludselig udviklende hyperkinesi, okulogyriske kriser, sammentrækninger af musklerne i ansigtet og overkroppen, opisthotonus. Disse lidelser er dosisafhængige og opstår ofte efter 2-5 dages behandling med meget potente neuroleptika såsom haloperidol og fluphenazin. For at lindre tidlig dyskinesi reduceres den neuroleptiske dosis, og antikolinerge lægemidler (biperiden, trihexyphenidyl) ordineres. Tardiv dyskinesi involverer normalt nakkemusklerne og er, i modsætning til akut dystonisk reaktion, mindre responsiv på behandling med antikolinergika. Neuroleptisk parkinsonisme er karakteriseret ved nedsat spontan motorik, hypo- og amimi, hviletremor og rigiditet. Det er vigtigt at skelne disse symptomer fra de tilsyneladende lignende negative lidelser ved skizofreni, som er repræsenteret ved følelsesmæssig fremmedgørelse, affektsvækkelse og anergi. For at korrigere disse bivirkninger er brugen af antikolinergika, en reduktion af dosis af neuroleptika eller dets erstatning med et atypisk antipsykotikum indiceret. Akatisi manifesterer sig ved indre angst, manglende evne til at forblive på ét sted i lang tid og behovet for konstant at bevæge arme eller ben. For at lindre dette anvendes antikolinergika og centrale betablokkere (propranolol).
Sen dyskinesi manifesterer sig ved ufrivillige bevægelser af enhver muskelgruppe, oftest musklerne i tungen og munden. Klinisk skelnes der mellem en række former: dyskinesi i musklerne i kinderne, tungen og munden (periodiske sammentrækninger af tyggemusklerne, hvilket skaber indtryk af en grimasserende person, tungen kan ufrivilligt stikke ud af patientens mund); tardiv dystoni og tardiv akatisi; (patienten foretager koreoatetoide bevægelser af hoved, torso, øvre og nedre lemmer). Denne form for lidelse registreres hovedsageligt under langvarig behandling med traditionelle neuroleptika og opdages hos cirka 15-20% af patienterne, der tager dem som vedligeholdelsesbehandling. Hos nogle patienter er risikoen for at udvikle dyskinesisymptomer sandsynligvis øget, da nogle af dem blev observeret i klinikken for skizofreni allerede før den "neuroleptiske æra". Derudover er tardiv dyskinesi blevet beskrevet hos ældre kvinder og patienter med affektive lidelser. Tardiv dyskinesi menes at være forbundet med en stigning i antallet af dopaminreceptorer i striatum, selvom GABAerge og andre neurotransmittersystemer sandsynligvis også er involveret i dens patogenese. Der findes ingen effektiv universel behandling for sådanne bivirkninger. Det foreslås, at lave doser af højpotente neuroleptika med dopaminblokerende virkning eller E-vitamin kan have en moderat gavnlig effekt ved disse lidelser. Den mest effektive foranstaltning til behandling af tardiv dyskinesi er en reduktion af dosis af et typisk neuroleptikum eller dets erstatning med et atypisk antipsykotikum.
Ifølge nuværende data forekommer neuroleptika malignt syndrom i cirka 0,5% af tilfældene af psykofarmakoterapi. Den sjældne forekomst af en sådan livstruende komplikation kan sandsynligvis i øjeblikket forklares ved den udbredte introduktion af atypiske antipsykotika i praksis, da risikoen for at udvikle NMS under behandling med disse lægemidler er ubetydelig. Det er generelt accepteret, at hovedårsagen til NMS-udvikling er overdreven blokade af det dopaminerge system under behandling med neuroleptika, især efter at have øget dosis af et meget potent antipsykotikum. De vigtigste symptomer på NMS er hypertermi, øget tonus i skeletmuskler og senereflekser, nedsat bevidsthed med overgang til koma. Blodprøver viser leukocytose, øget erytrocytsedimentationshastighed, levertransaminaseaktivitet; urinprøver viser tilstedeværelsen af albuminuri. Vand- og elektrolytbalanceforstyrrelser opstår hurtigt, hvilket skaber forudsætningerne for dannelsen af hjerneødem. NMS er en akut tilstand, der kræver akut indlæggelse af patienten til intensiv infusionsbehandling. Ved behandling af NMS er hydrering og symptomatisk behandling vigtigst. I denne situation kræver ordineret neuroleptika øjeblikkelig seponering. I nogle tilfælde har dopaminreceptoragonister (f.eks. bromocriptin) eller muskelafslappende midler en positiv effekt, selvom deres effektivitet ikke er undersøgt. Efter eliminering af NMS bør neuroleptika ikke genoptages i mindst to uger. Derefter kan et lavpotent antipsykotikum ordineres, helst et lægemiddel af den nye generation. Dosis af det nyligt ordinerede lægemiddel bør øges yderst omhyggeligt, under overvågning af vitale funktioner og laboratoriedata (blod- og urinprøver).
Typiske neuroleptika forårsager sjældent farlige, fatale komplikationer. Overdosismanifestationer er primært relateret til den individuelle profil af lægemidlets antiadrenerge og antikolinerge virkning. Da disse lægemidler har en stærk antiemetisk effekt, er maveskylning indiceret til deres eliminering fra kroppen snarere end administration af emetika. Arteriel hypotension er som regel en konsekvens af adrenerg receptorblokade, og det bør korrigeres ved administration af dopamin og noradrenalin. I tilfælde af hjertearytmi er brugen af lidokain indiceret.
Virkningsmekanisme og farmakologiske virkninger af typiske antipsykotika
Efterhånden som psykofarmakologien udviklede sig, blev der foreslået forskellige muligheder for antipsykotikas effekt på neuroreceptorer. Hovedhypotesen er fortsat, at de påvirker dopamin-neurostrukturer (primært D2-receptorer), baseret på data om forstyrrelse af normal dopaminmetabolisme i hjernestrukturer ved psykoser. Dopamin D2-receptorer er placeret i basalganglierne, nucleus accumbens og frontal cortex; de spiller en ledende rolle i reguleringen af informationsstrømmen mellem hjernebarken og thalamus.
Figuren viser en mere detaljeret forståelse af forstyrrelserne i dopamintransmissionen i hjernens kortikale og subkortikale områder og disse forstyrrelsers rolle i udviklingen af skizofrenisymptomer (tilpasset fra monografien af Jones RB, Buckley PF, 2006).
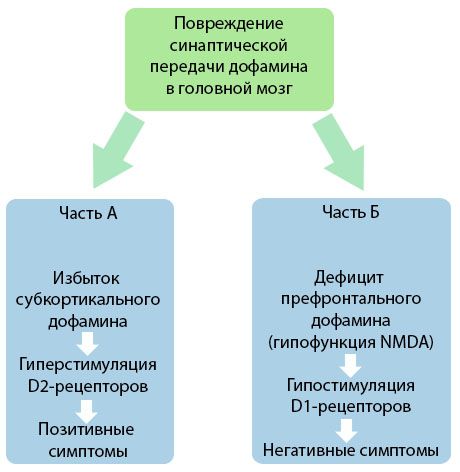
Del A afspejler den klassiske, tidlige dopaminteori, der postulerer et overskud af dopamin i subkortikale områder og hyperstimulering af D2-receptorer, hvilket fører til fremkomsten af produktive symptomer. Del B demonstrerer den efterfølgende modernisering af teorien i begyndelsen af 1990'erne. De data, der blev opnået på dette tidspunkt, viste, at en mangel på dopamin i D2-receptorer, sammen med utilstrækkelig stimulering af disse receptorer i den præfrontale cortex, fører til fremkomsten af negative symptomer og kognitive underskud. Derfor er begge typer dopaminerge transmissionsforstyrrelser - et overskud af subkortikal dopamin og dets mangel i den præfrontale cortex - ifølge moderne forståelse det kombinerede resultat af en forstyrrelse af synaptisk transmission i det præfrontale område og er forbundet med N-methyl-N-aspartat-hypofunktion. Ud over den oprindeligt isolerede dopamin blev andre neurotransmittere involveret i patogenesen af skizofreni senere identificeret, såsom serotonin, gamma-aminosmørsyre, glutamat, noradrenalin, acetylcholin og forskellige neuropeptider. Selvom disse mediatorers rolle ikke er fuldt undersøgt, bliver det ikke desto mindre, efterhånden som viden udvikles, klart, at de manifesterer sig af adskillige neurokemiske ændringer i kroppen. Derfor er den kliniske effekt af et antipsykotisk lægemiddel en summen af virkningerne på forskellige receptordannelser og fører til eliminering af homeostaseforstyrrelser.
I de senere år er der, på grund af fremkomsten af nye forskningsmetoder såsom radioisotopligandbinding og PET-scanning, gjort betydelige fremskridt i belysningen af neuroleptikas fine biokemiske virkningsmekanisme. Især er den komparative styrke og tropisme af lægemidler, der binder sig til individuelle neuroreceptorer i forskellige områder og strukturer i hjernen, blevet bestemt. En direkte afhængighed af sværhedsgraden af et lægemiddel's antipsykotiske effekt på styrken af dets blokerende effekt på forskellige dopaminerge receptorer er blevet vist. For nylig er fire typer af sådanne receptorer blevet identificeret:
- D1 er overvejende placeret i området omkring substantia nigra og striatum (den såkaldte nigrostriatale region), såvel som den præfrontale region;
- D2 - i de nigrostriatale, mesolimbiske regioner og den forreste hypofyse (sekretion af prolaktin);
- D3 (præsynaptisk) - i forskellige hjernestrukturer, kontrollerer dopaminerg aktivitet i henhold til loven om negativ feedback;
- D4 (præsynaptisk) - overvejende i de nigrostriatale og mesolimbiske områder.
Samtidig kan det nu betragtes som bevist, at det er blokaden af D2-receptorer, der forårsager udviklingen af antipsykotiske, sekundære beroligende virkninger samt ekstrapyramidale bivirkninger. Andre kliniske manifestationer af blokaden af denne type receptorer er den smertestillende og antiemetiske virkning af neuroleptika (reduktion af kvalme, opkastning som følge af undertrykkelse af opkastningscentret), samt et fald i indholdet af væksthormon og en stigning i produktionen af prolaktin (neuroendokrine bivirkninger, herunder galaktoré og menstruationsuregelmæssigheder). Langvarig blokade af nigrostriatale D2-receptorer fører til forekomsten af deres overfølsomhed, hvilket er ansvarligt for udviklingen af tardive dyskinesier og "overfølsomhedspsykoser". Sandsynlige kliniske manifestationer af blokaden af præsynaptiske D3- og D4-receptorer er hovedsageligt forbundet med den stimulerende virkning af neuroleptika. På grund af den delvise blokade af disse receptorer i de nigrostriatale og mesolimbokortikale områder kan aktiverende og incisive (kraftige, meget aktive) neuroleptika i små doser stimulere og i høje doser undertrykke dopaminerg transmission.
I de senere år er interessen for funktionen af hjernens serotonerge systemer, herunder serotoninreceptorer, steget kraftigt. Faktum er, at det serotonerge system i forskellige dele af hjernen har en modulerende effekt på dopaminerge strukturer. Især i den mesokortikale region hæmmer serotonin frigivelsen af dopamin, og følgelig fører blokaden af postsynaptiske 5-HT-receptorer til en stigning i dopaminindholdet. Som bekendt er udviklingen af negative symptomer ved skizofreni forbundet med hypofunktion af dopaminneuroner i de præfrontale strukturer i hjernebarken. I øjeblikket kendes omkring 15 typer centrale 5-HT-receptorer. Det er eksperimentelt blevet opdaget, at neuroleptika primært binder sig til 5-HT-receptorer af de første tre typer.
Disse lægemidler har primært en stimulerende (agonistisk) effekt på 5-HT1a-receptorer. Sandsynlige kliniske konsekvenser: øget antipsykotisk aktivitet, nedsat sværhedsgrad af kognitive forstyrrelser, korrektion af negative symptomer, antidepressiv effekt og nedsat forekomst af ekstrapyramidale bivirkninger.
Neuroleptikas effekt på 5-HT2-receptorer, især på 5-HT2a-subtyper, er af betydelig betydning. De er hovedsageligt placeret i hjernebarken, og deres følsomhed er øget hos patienter med skizofreni. Evnen hos den nye generation af neuroleptika til at reducere sværhedsgraden af negative symptomer, forbedre kognitive funktioner, regulere søvn ved at øge den samlede varighed af langsomme bølger (D-bølge) søvnfaser, reducere aggression og lindre depressive symptomer og migrænelignende (opstået som følge af cerebrovaskulære lidelser) hovedpine er forbundet med blokaden af 5-HT2a-receptorer. På den anden side er blokaden af 5-HT2a-receptorer mulige hypotensive effekter og ejakulationsforstyrrelser hos mænd.
Det menes, at neuroleptikas effekt på 5-HT2c-receptorer forårsager en beroligende (anxiolytisk) effekt, øget appetit (ledsaget af en stigning i kropsvægt) og et fald i prolaktinproduktionen.
5-HT3-receptorer er overvejende placeret i den limbiske region, og når de blokeres, udvikles den antiemetiske effekt først, og de antipsykotiske og angstdæmpende virkninger forstærkes også.
Forekomsten af Parkinsonisme-lignende symptomer afhænger også af lægemidlets blokerende kraft på muskariniske kolinerge receptorer. Kolinolytiske og dopaminblokerende virkninger er til en vis grad i gensidige forhold. Det er for eksempel kendt, at D2-receptorer i den nigrostriatale region hæmmer frigivelsen af acetylcholin. Når mere end 75% af D2-receptorerne i den nigrostriatale region er blokeret, forstyrres balancen til fordel for det kolinerge system. Dette er årsagen til den korrigerende effekt af antikolinerge lægemidler (korrektorer) på neuroleptiske ekstrapyramidale bivirkninger. Chlorprothixen, clozapin og olanzapin har en høj affinitet for muskariniske receptorer og forårsager praktisk talt ikke ekstrapyramidale bivirkninger, da de blokerer kolinerge og dopaminerge receptorer samtidigt. Haloperidol og piperazin-phenothiazin-derivater har en udtalt effekt på dopaminreceptorer, men har en meget svag effekt på kolinreceptorer. Dette skyldes deres evne til at forårsage udtalte ekstrapyramidale bivirkninger, som reduceres ved anvendelse af meget høje doser, når den kolinolytiske effekt bliver mærkbar. Ud over at reducere den dopaminblokerende effekt på D2-receptorer i nigrostriatalregionen og udjævne ekstrapyramidale bivirkninger, kan en stærk kolinerg effekt forårsage forringelse af kognitive funktioner, herunder hukommelsesforstyrrelser, samt perifere bivirkninger (tørre slimhinder, nedsat synsevne, forstoppelse, urinretention, forvirring osv.). Neuroleptika har en ret stærk blokerende effekt på type I histaminreceptorer, hvilket først og fremmest er forbundet med sværhedsgraden af den beroligende effekt, samt en stigning i kropsvægt på grund af øget appetit. De antiallergiske og kløestillende virkninger af neuroleptika er også forbundet med deres antihistaminegenskaber.
Udover dopaminblokerende, antiserotonerge, kolinolytiske og antihistaminiske effekter har de fleste neuroleptika adrenolytiske egenskaber, dvs. de blokerer både centrale og perifere a1-adrenoreceptorer. Adrenoblokkere som chlorpromazin og chlorprothixen har en udtalt beroligende effekt. Derudover kan den blokerende effekt af disse lægemidler forårsage neurovegetative bivirkninger (arteriel hypotension, takykardi osv.) samt en forøgelse af den hypotensive effekt af adrenoblokkere.
Et stort antal forfatteres værker giver data om bindingsstyrken (affiniteten) af individuelle neuroleptika med forskellige typer neuroreceptorer.
Baseret på deres neurokemiske virkningsprofil kan typiske og atypiske antipsykotika, blandt dem der overvejende anvendes i klinisk praksis, betinget opdeles i seks grupper.
Den første gruppe består af selektive blokkere af D2- og D4-receptorer (sulpirid, amisudprid, haloperidol osv.) fra grupperne af benzamid- og butyrophenonderivater. I små doser, primært på grund af blokaden af præsynaptiske D4-receptorer, aktiverer de dopaminerg transmission af nerveimpulser og har en stimulerende (disinhibitorisk) effekt, i store doser blokerer de D2-receptorer i alle områder af hjernen, hvilket klinisk manifesterer sig ved en udtalt antipsykotisk effekt, såvel som ekstrapyramidale og endokrine (på grund af prolaktinæmi) bivirkninger.
Den anden gruppe omfatter højaktive D2-receptorblokkere, såvel som lægemidler, der svagt eller moderat blokerer 5-HT2a- og 5-HT1a-receptorer (flupentixol, fluphenazin, zuclopenthixol osv.), dvs. hovedsageligt piperazinderivater af phenothiazin eller thioxanthener, der har en stereokemisk struktur, der ligner dem. Ligesom lægemidlerne i den første gruppe har disse neuroleptika først og fremmest en udtalt antipsykotisk (skarp) effekt og forårsager også ekstrapyramidale pye-effekter og prolaktinæmi. I små doser har de en moderat aktiverende (psykostimulerende) effekt.
Den tredje gruppe består af polyvalente sedative neuroleptika, der blokerer de fleste neuroreceptorer på en udifferentieret måde. Disse lægemidler har en tydeligt udtalt blokerende effekt på dopaminreceptorer og forårsager også stærke adrenolytiske og kolinolytiske virkninger. Dette omfatter de fleste sedative neuroleptika, primært alifatiske og piperidinderivater af phenothiazin, samt thioxanthener, der er tæt på dem i stereokemisk struktur (chlorpromazin, levomepromazin, chlorprothixen osv.). Spektret af psykotrop aktivitet af disse lægemidler domineres først og fremmest af en udtalt primær sedativ effekt, der udvikles uanset den anvendte dosis, og en moderat antipsykotisk effekt. Derudover forårsager lægemidler i denne gruppe på grund af deres udtalte antikolinerge effekt svage eller moderate ekstrapyramidale og neuroendokrine bivirkninger, men fører ofte til udvikling af ortostatisk hypotension og andre autonome reaktioner på grund af udtalt blokade af a1-adrenerge receptorer.
Den fjerde gruppe omfatter neuroleptika, der blokerer D2- og 5-HT2a-receptorer på en balanceret måde, dvs. i samme grad (sidstnævnte i lidt større grad), og a1-adrenoreceptorer i moderat grad. Denne gruppe omfatter repræsentanter for den nye generation af atypiske antipsykotika (risperidon, ziprasidon, sertindol), som har forskellige kemiske strukturer. Den neurokemiske virkningsmekanisme bestemmer deres selektive indflydelse primært på hjernens mesolimbiske og mesokortikale områder. Sammen med en tydelig antipsykotisk effekt, fravær eller svag ekspression af ekstrapyramidale bivirkninger (ved anvendelse af terapeutiske doser), svag eller moderat prolaktinæmi og moderate adrenolytiske egenskaber (hypotensive reaktioner) er denne gruppe af neuroleptika i stand til at korrigere negative symptomer ved indirekte stimulering af dopaminerg transmission i hjernebarken.
Den femte gruppe består af polyvalente atypiske antipsykotika med tricyklisk dibenzodiazepin eller lignende struktur (clozapin, olanzapin og quetiapin). Ligesom lægemidlerne i den tredje gruppe blokerer de de fleste neuroreceptorer på en udifferentieret måde. 5-HT2a-receptorer blokeres dog kraftigere end D2- og D4-receptorer, især dem, der er placeret i den nigrostriatale region. Dette bestemmer den faktiske fravær eller svage ekstrapyramidale effekt og fraværet af neuroendokrine bivirkninger forbundet med øget prolaktinproduktion med en tydelig antipsykotisk effekt og evnen til at reducere sværhedsgraden af negative symptomer. Derudover har alle lægemidler i denne gruppe udtalte adrenolytiske og antihistaminiske egenskaber, hvilket bestemmer den beroligende og hypotensive effekt. Clozapin og olanzapin har også en ret udtalt blokerende effekt på muskarinreceptorer og fører til udvikling af kolinolytiske bivirkninger.
Evnen til at blokere postsynaptiske dopaminerge receptorer med en kompenserende stigning i syntesen og metabolismen af dopamin er således den eneste fælles biokemiske egenskab for alle neuroleptika, der betragtes i disse grupper.
Den sjette gruppe omfatter det eneste atypiske antipsykotikum, aripiprazol, som relativt nylig er dukket op på det indenlandske psykofarmakamarked. Dette lægemiddel er en partiel agonist af D2-dopaminreceptorer og fungerer som en funktionel antagonist i en hyperdopaminerg tilstand og som en funktionel agonist i en hypodopaminerg profil. En sådan unik receptorprofil af aripiprazol gør det muligt at reducere risikoen for ekstrapyramidale lidelser og hyperprolaktinæmi ved brug. Derudover fungerer aripiprazol som en partiel agonist af 5-HT1a-receptorer og samtidig en antagonist af 5-HT2a-receptorer. Det antages, at en sådan interaktion med receptorer fører til en generelt afbalanceret funktion af serotonin- og dopaminsystemerne, så virkningsmekanismen for aripiprazol kan betegnes som stabilisering af dopamin-serotoninsystemet.
Den nuværende viden om neuroleptikas neurokemiske virkningsmekanismer giver os således mulighed for at foreslå en ny, patogenetisk mere underbygget farmakodynamisk klassificering af denne gruppe af psykotrope lægemidler. Brugen af denne klassificering giver os mulighed for i vid udstrækning at forudsige spektret af psykotrop aktivitet, tolerance og sandsynlige lægemiddelinteraktioner for et bestemt lægemiddel. Med andre ord bestemmer kendetegnene ved et lægemiddel's neurokemiske aktivitet i høj grad kendetegnene ved dets kliniske aktivitet, som bør anvendes ved valg af et bestemt antipsykotisk lægemiddel til en specifik patient.
Effektiviteten af den globale antipsykotiske effekt af ethvert neuroleptikum estimeres ved hjælp af den såkaldte chlorpromazinækvivalent, som tages som 1. For eksempel er chlorpromazinækvivalenten af haloperidol = 50. Det betyder, at den antipsykotiske effektivitet af 1 mg haloperidol er sammenlignelig med 50 mg chlorpromazin. Baseret på denne indikator er der udviklet en klassificering, der giver mulighed for at opdele neuroleptika i høj (chlorpromazinækvivalent> 10,0), medium (chlorpromazinækvivalent = 1,0-10,0) og lav (chlorpromazinækvivalent = 1,0) antipsykotisk aktivitet, kaldet patentitet. Typiske neuroleptika (første generations antipsykotika) har været meget anvendt i klinisk psykofarmakoterapi i næsten et halvt århundrede. Deres terapeutiske aktivitet omfatter:
- global antipsykotisk virkning i form af evnen til jævnt og differentieret at reducere forskellige manifestationer af psykose:
- primær beroligende (hæmmende) effekt - lægemidlers evne til hurtigt at lindre psykomotorisk agitation;
- selektiv, selektiv antipsykotisk virkning, manifesteret i evnen til at påvirke individuelle symptomer: delirium, hallucinationer, desinficering af drifter osv.;
- aktiverende (disinhibitorisk, disinhibitorisk, antiautistisk) neurotropisk virkning, manifesteret ved udvikling af ekstrapyramidale symptomer;
- somatotropisk virkning i form af udvikling af neuroendokrine og vegetative bivirkninger;
- depressiv effekt, udtrykt i visse antipsykotikas evne til at forårsage depressive symptomer.
Effektiviteten af førstegenerations antipsykotika i behandlingen af ikke kun psykotiske lidelser, men også lidelser inden for borderlinepsykiatri er blevet bevist mange gange og er indiskutabel. Derfor, på trods af den høje hyppighed af bivirkninger ved behandling, når de ordineres, anvendes de fortsat i lægepraksis.
Atypiske antipsykotika
Moderne retningslinjer indeholder data om fordelene ved at bruge anden generations antipsykotika i farmakoterapi. Udtrykket "atypisk" (synonym - anden generations antipsykotika) er betinget og bruges primært for at gøre det nemmere at betegne den nye generation. Sammenlignet med traditionelle neuroleptika er lægemidler i denne gruppe mere effektive til at korrigere negative, affektive og kognitive lidelser, hvilket kombineres med bedre tolerabilitet og en lavere risiko for ekstrapyramidale symptomer. Forskelle i arten af den terapeutiske effekt af det ene eller det andet lægemiddel fra en række atypiske antipsykotika forklares, ligesom i gruppen af typiske neuroleptika, af dets individuelle farmakologiske virkningsprofil.
For at afklare mulighederne for psykofarmakaterapi med atypiske antipsykotika, er det tilrådeligt at fokusere på lægemidler i denne gruppe, der er registreret i Rusland.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Clozapin (dibenzodiazepin)
Grundlæggeren af gruppen af atypiske antipsykotika. Clozapins virkningsmekanisme er karakteriseret ved en let blokade af D2-receptorer med samtidig høj antagonisme mod 5-HT2a-receptorer, a1-, a2-adrenerge og H1-histaminreceptorer. Det har vist sig at være et effektivt antipsykotikum i tilfælde af resistens over for andre antipsykotika (et lægemiddel fra reservegruppen) og er også indiceret til behandling af kronisk mani, psykotisk agitation og aggression. I hjemmepraksis ordineres clozapin ofte for at opnå sedation og som hypnotikum hos psykotiske patienter. Det skal erkendes, at en sådan anvendelse af clozapin ikke svarer til dets primære indikationsprofil for brug i terapi. Holdningen til dette antipsykotikum som et lægemiddel af sekundær betydning bør sandsynligvis revideres, da det i dag er det eneste lægemiddel med dokumenteret effektivitet hos resistente patienter.
Clozapin forårsager, i modsætning til typiske neuroleptika, ikke alvorlige ekstrapyramidale lidelser på grund af den førnævnte lave affinitet for O2-receptorer. Det har også vist sig, at det kan bruges til behandling af sen dystoni og svær akatisi. På grund af den lave risiko for at udvikle malign neuroleptika (NMS) kan clozapin betragtes som et lægemiddel af højeste kvalitet hos patienter, der tidligere har lidt af denne komplikation.
Der kan dog opstå en række alvorlige bivirkninger under behandling med clozapin. Den farligste af dem (selv når der ordineres små doser) er agranulocytose, som forekommer hos 0,5-1,0% af patienterne. Andre vigtige bivirkninger, der kan opstå ved brug af lægemidlet, omfatter døsighed, hypersalivation og vægtøgning, som ofte allerede er forhøjet, når clozapin ordineres under påvirkning af tidligere antipsykotisk behandling. Man bør også være opmærksom på muligheden for at udvikle takykardi, arteriel hypotension og epileptiske anfald under indtagelse. Sandsynligheden for anfald afhænger af dosis. Risikoen for anfald øges betydeligt, hvis clozapin-dosis overstiger 600 mg/dag. Udvikling af anfald er ikke en kontraindikation for yderligere brug af lægemidlet, men kræver en halvering af dosis og ordination af antikonvulsiva, såsom valproinsyre. Forebyggelse af bivirkninger ved behandling med clozapin omfatter omhyggelig overvågning af antallet af hvide blodlegemer samt EKG og endokrine parametre.
Overdosis af clozapin kan forårsage bevidsthedssvækkelse op til udvikling af koma, samt symptomer forbundet med den kolinolytiske effekt (takykardi, delirium), epileptiske anfald, respirationsdepression og ekstrapyramidale syndromer. Dødelig udgang kan forekomme ved indtagelse af en dosis på over 2500 mg af lægemidlet.
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ], [ 41 ]
Risperidon
Et benzisoxazolderivat med høj affinitet for serotonin- og dopamin Dj-receptorer med en dominerende effekt på serotoninsystemet. Lægemidlet har en bred vifte af indikationer for brug, herunder lindring af eksacerbationer, behandling mod tilbagefald, behandling af den første psykotiske episode og korrektion af negative symptomer på skizofreni. Lægemidlet har vist sig at forbedre kognitiv funktion hos patienter med skizofreni. Der er indhentet foreløbige data om, at risperidon også reducerer komorbide affektive symptomer hos patienter med skizofreni og kan være et foretrukket lægemiddel i behandlingen af bipolære affektive lidelser.
Bivirkninger ved risperidonbehandling, især ekstrapyramidale lidelser, er dosisafhængige og forekommer oftere ved doser over 6 mg/dag. Andre bivirkninger omfatter kvalme, opkastning, angst, døsighed og forhøjede serumprolaktinniveauer. Langvarig brug af risperidon kan føre til vægtøgning og udvikling af type 2-diabetes mellitus, men med en lavere sandsynlighed sammenlignet med clozapin og olanzapin.
Overdosis kan forårsage døsighed, epileptiske anfald, forlængelse af QT-intervallet og udvidelse af QRS-komplekset samt arteriel hypotension. Der er beskrevet tilfælde af dødelig udgang som følge af overdosis af risperidon.
Den utvivlsomme fordel ved lægemidlet er tilgængeligheden af flydende og hurtigtopløselige (sublinguale) former, hvis anvendelse fremskynder lægemidlets optagelse i patientens krop og letter kontrollen over dets indtag. Der findes også en forlænget form af lægemidlet - pulver til fremstilling af en suspension til intramuskulær administration (consta-risperidon i mikrosfærer). Det anbefales til vedligeholdelsesbehandling af patienter med skizofreni, især for patienter med dårlig compliance. Det er nødvendigt at tage højde for, at lægemidlet har brug for cirka tre uger til at trænge ind i blodbanen. Derfor skal patienten, når behandlingen med consta-risperidon påbegyndes, desuden tage den orale form af risperidon i mindst 3 uger efter den første injektion.
Olanzapin
Med hensyn til farmakologisk virkning er det tæt på clozapin, da det har en pleiomorf receptorprofil med betydelig affinitet for serotonin-, muskarin-, a1-adrenerge og histaminreceptorer. Olanzapins terapeutiske aktivitet har træk, der ligner clozapins og risperidons effektivitet med hensyn til virkningen på positive, negative og depressive symptomer på skizofreni. Samtidig er der indsamlet data om olanzapins større effektivitet sammenlignet med andre atypiske antipsykotika hos patienter med den første psykotiske episode og i korrektionen af kognitive funktionsindikatorer. Det skal tages i betragtning, at der i begyndelsen af behandlingen med tabletformen kan forekomme en hurtig disinhibitorisk effekt med øget psykomotorisk agitation og angst. Derfor er brugen af injektionsformen af lægemidlet indiceret ved behandling af anfald ledsaget af svær psykomotorisk agitation.
Olanzapin forårsager sjældent ekstrapyramidale lidelser eller tardiv dyskinesi, og de mest almindelige bivirkninger ved brugen er metaboliske forstyrrelser og vægtøgning. Det er blevet fastslået, at patienter, der får olanzapin, ofte oplever forhøjede niveauer af kolesterol, plasmalipider og en prædisponering for type 2-diabetes mellitus, men sådanne virkninger var lige så almindelige hos patienter, der fik både olanzapin og clozapin. Samtidig er der indhentet data, der viser, at vægtøgning korrelerer med et positivt respons på olanzapin (dvs. fungerer som en vigtig prognostisk indikator for behandling) og kun udvikler sig til fedme hos 20-30% af patienter, der har taget overvægt på under behandlingen.
Overdosis kan forårsage sedation, toksiske antikolinerge virkninger, epileptiske anfald og arteriel hypotension. Der er i øjeblikket ingen overbevisende data til at vurdere risikoen for død ved overdosis.
Quetiapin
Det er klassificeret som en dibenzothiazepinforbindelse. Dets receptorprofil ligner stort set clozapins. Quetiapins bindingsniveau til D2-receptorer er lavt (mindre end 50%) og kortvarigt, selv når der anvendes høje doser. Lægemidlet er effektivt til behandling af positive, negative og generelle symptomer på skizofreni. Der er bevis for dets succesfulde anvendelse både i tilfælde af høj resistens over for behandling og til forbedring af patienters kognitive funktion, hvilket giver ret til at anbefale det som et førstelinjeantipsykotikum til vedligeholdelsesbehandling af skizofreni. Endelig har quetiapin en moderat antidepressiv, aktiverende effekt. Derfor er det indiceret til behandling af depressive-vrangforestillingsanfald og lidelser i den senesto-hypokondriske cirkel.
Quetiapins etablerede høje thymotropiske aktivitet forklarer, at det er registreret som et middel til lindring og sekundær forebyggelse af depressive lidelser. Til behandling af maniske episoder inden for bipolar lidelse af type I og II anvendes quetiapin som et supplerende middel. Fraværet af injektionsformer begrænser i nogen grad dets anvendelse hos patienter med agitation og aggressiv adfærd.
Quetiapin tolereres godt, det forårsager praktisk talt ikke ekstrapyramidale syndromer, undtagen i tilfælde hvor maksimale doser anvendes. Quetiapin forårsager ikke hyperprolaktinæmi, sjældnere end olanzapin og clozapin, det fører til vægtøgning og nedsat glukosetolerance.
Ziprasidon
Har en unik profil af receptoraktivitet. Som en potent antagonist af 5HT2a-receptorer og D2-receptorer er det også en aktiv hæmmer af serotonin- og noradrenalin-genoptagelse. Kliniske studier har vist signifikant overlegenhed af ziprasidon i dets effekt på psykotiske symptomer og manifestationer af aggression sammenlignet med haloperidol. Der er også data om den positive effekt af ziprasidon på de kognitive funktioner hos patienter med skizofreni, såvel som på komorbide affektive symptomer, indikatorer for social funktion. Ziprasidon tolereres normalt godt og forårsager meget sjældent ekstrapyramidale syndromer, vægtøgning og metaboliske forstyrrelser. Oftere er der en forlængelse af QT-intervallet over 460 ms, derfor tilrådes det for patienter, der får dette lægemiddel, at gennemgå en EKG-undersøgelse både før ordination af lægemidlet og kontrolovervågning under behandlingen. Der bør lægges særlig vægt på samtidig behandling (indtagelse af antiarytmika), som kan forværre forlængelsen af QT-intervallet og føre til udvikling af hjertearytmi, ventrikelflimmer.
Sertindol
Tilhører derivater af phenylindol. Det har høj funktionel antagonisme i forhold til D2-, serotonin- (især 5-HT2a-receptorer) og a1-adrenerge receptorer. Ifølge elektroneurokemiske studier hæmmer sertindol selektivt dopaminreceptorer i den ventrale segmentale region. En sådan selektivitet sikrer højst sandsynligt en lav risiko for ekstrapyramidale syndromer og hyperprolaktinæmi ved brug af lægemidlet. Resultaterne af sammenlignende studier har vist, at sertindol er sammenlignelig med haloperidol med hensyn til antipsykotisk aktivitet. Lægemidlet har en udtalt disinhibitorisk effekt hos patienter med negative og depressive symptomer, hvilket er bedre end en lignende effekt af rispolept. Der er også beviser, der bekræfter sertindols effektivitet til korrektion af kognitiv svækkelse hos patienter med skizofreni. Sertindol tolereres generelt godt af patienter, forårsager sjældent sedation og anbefales derfor som erstatningslægemiddel, når der opstår bivirkninger under behandling med andre moderne antipsykotika.
Alvorlige bivirkninger omfatter lægemidlets evne til at forlænge QT-intervallet, hvilket kan føre til hjertearytmi. Ved analyse af postmarketingstudier blev det klart, at sertindols hjerteprofil ikke adskiller sig fra andre antipsykotika af den nye generation.
Aripiprazol
Det har antipsykotisk aktivitet, der kan sammenlignes med andre atypiske midler, men har en større effekt på parametrene for kognitiv funktion hos patienter med skizofreni. Den ovennævnte unikke farmakologiske virkning af lægemidlet - en partiel agonist af D2-receptorer - gør det muligt at reducere risikoen for ekstrapyramidale syndromer og hyperprolaktinæmi ved brug.
 [ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
[ 42 ], [ 43 ], [ 44 ], [ 45 ], [ 46 ], [ 47 ]
Amisulprid
Tilhører klassen af substituerede benzamider. Lægemidlet binder selektivt til undertyperne af D2- og D3-dopaminerge receptorer, har ingen affinitet for undertyperne af D1, D4 og D5, såvel som for serotonin, H1-histamin, a1-adrenerge og kolinerge receptorer. Når det anvendes i høje doser, blokerer det postsynaptiske D2-receptorer. I lave doser manifesterer dets disinhibitoriske effekt sig på grund af blokaden af præsynaptiske D2-, D3-receptorer, hvilket gør dets anvendelse også effektiv til behandling af negative symptomer, selvom det ikke er en kombineret antagonist af D2-receptorer og serotoninreceptorer. Resultaterne af en række undersøgelser indikerer en udtalt antipsykotisk aktivitet af lægemidlet, når det anvendes i høje doser, hvilket er bedre end traditionelle lægemidler.
 [ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
[ 48 ], [ 49 ], [ 50 ], [ 51 ], [ 52 ], [ 53 ], [ 54 ], [ 55 ]
Bivirkninger af antipsykotisk behandling
Tabellen viser de vigtigste bivirkninger ved atypisk antipsykotisk behandling.
Forberedelse |
Ekstrapyramidale |
Ledningsforstyrrelse på EKG |
Metaboliske forstyrrelser (vægtøgning, forhøjede niveauer af glukose, kolesterol, triglycerider i blodet) |
||
Clozapin |
. |
++ |
++ |
++- |
|
Risperidon |
++ |
+/- |
++ |
+/- |
|
Olanzapin |
+ |
+/- |
+++ |
++ |
+++ |
Quetiapin |
+/- |
+ |
+/- |
--- |
|
Ziprasidon |
+ |
++ |
+/- |
+/- |
+/- |
Sertindol |
++ |
-- |
+/- |
-- |
|
Ariliprazol |
-- |
--- |
+/- |
-- |
-- |
Amisulprid |
++ |
+/- |
|||
Bemærk. Sværhedsgraden af bivirkninger: "+++" - høj; "++" - gennemsnitlig; "+" - lav; "+/-" - tvivlsom; "-" - fraværende.
Ekstrapyramidale syndromer
Et af hovedtræk ved atypiske antipsykotika, i modsætning til traditionelle, er deres lave evne til at forårsage ekstrapyramidale syndromer, hvilket blev et gennembrud i vedligeholdelsesbehandlingen af skizofreni. Som det fremgår af dataene i tabellen, kan sådanne symptomer dog forekomme ved brug af individuelle lægemidler i denne serie (risperidon, amisulprid), hvilket kræver særlig opmærksomhed ved ordination.
 [ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
[ 3 ], [ 4 ], [ 5 ], [ 6 ], [ 7 ], [ 8 ], [ 9 ], [ 10 ]
EKG-afvigelser
Muligheden for at udvikle kardiale bivirkninger er et alvorligt problem ved brug af visse moderne antipsykotika i terapi. I disse tilfælde taler vi om forlængelse af QT-intervallet, hvilket kan føre til udvikling af arytmi. Ledningsforstyrrelser, primært forlængelse af QT-intervallet, observeres oftest under behandling med clozapin, sertindol og ziprasidon. Samtidig patologi i form af bradykardi, atrioventrikulær blok og hypothyroidisme kan bidrage til forekomsten af denne komplikation under behandling med de ovennævnte lægemidler. I øjeblikket anbefales EKG-monitorering cirka hver 3. måned hos patienter, der får vedligeholdelsesbehandling med atypiske antipsykotika.
 [ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
[ 11 ], [ 12 ], [ 13 ], [ 14 ], [ 15 ]
Endokrine lidelser
I øjeblikket er den største bekymring atypiske antipsykotiske lægemidlers evne til at forårsage vægtøgning. Øget kropsvægt, glukose- og triglyceridniveauer i blodet kan føre til metaboliske forstyrrelser og udvikling af type 2-diabetes. Særlig forsigtighed og ugentlig overvågning af biokemiske parametre er nødvendig under behandling med clozapin og olanzapin. Ifølge J. Geddes et al. (2000), PB Jones, PF Buckley (2006) bør det anerkendes som passende at foretage en grundig undersøgelse af patienter, før de ordineres et bestemt antipsykotikum af den moderne generation, da det er kendt, at metaboliske forstyrrelser oftere forekommer hos patienter, der havde en arvelig prædisposition, overvægt, lipidspektrumforstyrrelser og hyperglykæmi før behandlingsstart. Overvågningsalgoritmen foreslået af PB Jones, PF Buckley (2006) omfatter flere punkter.
- Indsamling af sygehistorie og familiefaktorer vedrørende risikoen for metaboliske lidelser.
- Registrering af kropsmasseindeks, EKG, blodtryk og puls før behandlingsstart.
- Indsamling af laboratoriedata (glukose, lipidprofil, kolesterol) før behandlingsstart.
- Regelmæssig overvågning af kropsmasseindeks og vitale tegn under behandlingen.
- Overvågning af laboratoriedata under behandling.
Forekomsten af hyperprolaktinæmi under antipsykotisk behandling skyldes central blokade af dopaminreceptorer i hypothalamus, hvilket fører til frigivelse af prolaktin fra den forreste hypofyse. Hyperprolaktinæmi forekommer oftest ved behandling med olanzapin, risperidon og amisulprid.
 [ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
[ 16 ], [ 17 ], [ 18 ], [ 19 ], [ 20 ]
Agranulocytose
En anden alvorlig komplikation ved antipsykotisk behandling. Den kan observeres under behandling med clozapin og olanzapin. Ifølge J. Geddes et al. (2000) blev den diagnosticeret i løbet af de første 3 måneder hos 1-2% af patienterne, der tager disse lægemidler. I den forbindelse anbefales ugentlige blodprøver til patienter, der tager disse lægemidler i løbet af de første 18 ugers behandling, og derefter månedlig overvågning. Det har vist sig, at når dosis af de ovennævnte neuroleptika reduceres, vender den kliniske blodprøve tilbage til normal. Samtidig skal det erkendes, at der indtil videre ikke findes nogen klar strategi for patienter, der oplever de ovennævnte bivirkninger forbundet med stofskifteforstyrrelser. Oftest erstattes et atypisk antipsykotikum af et andet. En anden lovende retning er udnævnelse af speciel korrigerende behandling, især brugen af bromocriptin til at korrigere hyperprolaktinæmi. Den ideelle situation er en, hvor plejen af en patient med sådanne lidelser udføres med periodisk inddragelse af internistlæger, især endokrinologer, kardiologer og andre specialister.
Afslutningsvis skal det bemærkes, at hvis de givne algoritmer til ordination og overvågning af ikke blot patienternes mentale, men også deres fysiske tilstand følges, er brugen af andengenerationslægemidler sikrere end typiske neuroleptika.
En række andre antipsykotika er i øjeblikket i udviklingsfasen. Næste generations lægemidler vil sandsynligvis have en anden virkningsmekanisme (for eksempel en GABAergisk profil) og vil være i stand til at påvirke forskellige manifestationer af skizofreni, herunder egentlige deficitforstyrrelser.
Opmærksomhed!
For at forenkle opfattelsen af information, er denne instruktion til brug af lægemidlet "Neuroleptika eller antipsykotika " oversat og præsenteret i en speciel form på grundlag af de officielle instruktioner til medicinsk brug af stoffet. Før brug skal du læse annotationen, der kom direkte til medicinen.
Beskrivelse er givet til orienteringsformål og er ikke vejledning til selvhelbredelse. Behovet for dette lægemiddel, formålet med behandlingsregimen, metoder og dosis af lægemidlet bestemmes udelukkende af den behandlende læge. Selvmedicin er farligt for dit helbred.

