Medicinsk ekspert af artiklen
Nye publikationer
Patogenese af hepatitis B
Sidst revideret: 07.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
I patogenesen af hepatitis B kan flere ledende led i den patogenetiske kæde identificeres:
- introduktion af patogenet - infektion;
- fiksering på hepatocytten og penetration ind i cellen;
- multiplikation af virussen og dens "udbredelse" på levercellernes overflade såvel som i blodet;
- aktivering af immunologiske reaktioner, der sigter mod at eliminere patogenet;
- immunkompleksskader på organer og systemer;
- dannelse af immunitet, frigivelse fra patogenet, genopretning.
Da infektion med hepatitis B altid sker parenteralt, kan det antages, at infektionsøjeblikket praktisk talt svarer til virussens penetration i blodet. Nogle forskeres forsøg på at skelne mellem enterale og regionale faser i hepatitis B er dårligt underbyggede. Der er mere grund til at tro, at virusset straks trænger ind i leveren med blodgennemstrømningen.
Hepatitis B-virussens tropisme til levervæv er forudbestemt af tilstedeværelsen af en særlig receptor i HBsAg - et polypeptid med en molekylvægt på 31.000 Da (P31), som har albuminbindende aktivitet. En lignende albuminzone findes også på membranen af hepatocytter i leveren hos mennesker og chimpanser, hvilket i det væsentlige bestemmer HBV's tropisme til leveren hos mennesker og chimpanser.
Når virussen trænger ind i hepatocytten, frigives viralt DNA, som, når det kommer ind i hepatocytkernen og fungerer som en matrix for syntesen af nukleinsyrer, udløser en række sekventielle biologiske reaktioner, hvis resultat er samlingen af virussens nukleokapsidet. Nukleokapsidet migrerer gennem kernemembranen ind i cytoplasmaet, hvor den endelige samling af Dane-partikler - den komplette hepatitis B-virus - finder sted.
Det skal dog bemærkes, at når en hepatocyt inficeres, kan processen forløbe på to måder - replikativ og integrativ. I det første tilfælde udvikles et billede af akut eller kronisk hepatitis, og i det andet - virusbærer.
Årsagerne til de to typer interaktion mellem viralt DNA og hepatocytter er ikke præcist fastslået. Mest sandsynligt er typen af respons genetisk bestemt.
Resultatet af replikativ interaktion er samlingen af kerneantigenstrukturerne (i kernen) og samlingen af den komplette virus (i cytoplasmaet), efterfulgt af præsentationen af den komplette virus eller dens antigener på membranen eller i hepatocytmembranens struktur.
Det er generelt accepteret, at virusreplikation ikke resulterer i celleskade på hepatocytniveau, da hepatitis B-virus ikke har en cytopatisk effekt. Denne holdning kan ikke betragtes som ubestridelig, da den er baseret på eksperimentelle data, der, selvom de indikerer fraværet af en cytopatisk effekt af hepatitis B-virus, blev opnået på vævskulturer og derfor ikke fuldt ud kan ekstrapoleres til viral hepatitis B hos mennesker. Under alle omstændigheder kræver spørgsmålet om fraværet af hepatocytskade under replikationsfasen yderligere undersøgelse.
Uanset arten af virussens interaktion med cellen er leveren nødvendigvis inkluderet i den immunopatologiske proces. I dette tilfælde er skaden på hepatocytter forbundet med, at som følge af ekspressionen af virale antigener på hepatocytmembranen og frigivelsen af virale antigener i fri cirkulation, er en kæde af sekventielle cellulære og humorale immunreaktioner inkluderet, der i sidste ende har til formål at fjerne virussen fra kroppen. Denne proces udføres i fuld overensstemmelse med de generelle mønstre for immunresponset på virusinfektioner. For at eliminere patogenet er cellulære cytotoksiske reaktioner medieret af forskellige klasser af effektorceller: K-celler, T-celler, naturlige dræbere, makrofager. Under disse reaktioner ødelægges de inficerede hepatocytter, hvilket ledsages af frigivelsen af virale antigener (HBcAg, HBeAg, HBsAg), som udløser antistofgenesesystemet, hvorved specifikke antistoffer akkumuleres i blodet, primært mod kernen - anti-HBc og e-antigen - anti-HBE. Følgelig sker frigivelsen af levercellen fra virussen i processen med dens død på grund af reaktionerne ved cellulær cytolyse.
Samtidig binder specifikke antistoffer, der akkumuleres i blodet, virusantigenerne og danner immunkomplekser, der fagocyteres af makrofager og udskilles af nyrerne. I dette tilfælde kan forskellige immunkomplekslæsioner forekomme i form af glomerulonefritis, arteritis, ledsmerter, hududslæt osv. Ved deltagelse af specifikke antistoffer renses kroppen for patogenet, og fuldstændig helbredelse sker.
I overensstemmelse med det skitserede koncept for patogenesen af hepatitis B, forklares al den kliniske variation i sygdomsforløbet normalt af virussens interaktion og immunkompetente cellers samarbejde, med andre ord, styrken af immunresponset på tilstedeværelsen af virale antigener. Ifølge moderne koncepter er styrken af immunresponset genetisk bestemt og knyttet til histokompatibilitetsantigenerne i HLA-locus af første klasse.
Det er generelt accepteret, at under betingelser med et tilstrækkeligt immunrespons på virusantigener udvikler akut hepatitis sig klinisk med et cyklisk forløb og fuldstændig helbredelse. På baggrund af et fald i immunresponset på virusantigener udtrykkes immunmedieret cytolyse ubetydeligt, derfor er der ingen effektiv eliminering af inficerede leverceller, hvilket fører til milde kliniske manifestationer med langvarig persistens af virussen og muligvis udvikling af kronisk hepatitis. Samtidig opstår der tværtimod i tilfælde af et genetisk bestemt stærkt immunrespons og massiv infektion (hæmotransfusion) omfattende områder med levercelleskade, hvilket klinisk svarer til alvorlige og maligne former af sygdommen.
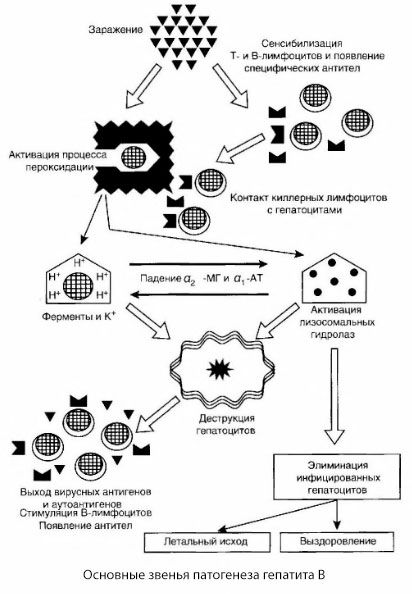
Den præsenterede ordning for patogenesen af hepatitis B er kendetegnet ved dens sammenhæng; den indeholder dog en række kontroversielle og dårligt undersøgte punkter.
Hvis vi følger konceptet om hepatitis B som en immunopatologisk sygdom, kan vi forvente en stigning i cellulære cytotoksiske reaktioner med stigende sværhedsgrad af sygdommen. I alvorlige former reduceres indekserne for den cellulære immunitetsforbindelse dog kraftigt, herunder et flerdobbelt fald, sammenlignet med dem hos raske børn, og K-celle cytotoksicitetsindekset. I den maligne form, i perioden med udvikling af massiv levernekrose og især hepatisk koma, observeres en fuldstændig manglende evne hos lymfocytterne til at gennemføre transformation under påvirkning af fytohæmattlutinin, stafylokok-endotoksin og HBsAg. Derudover er der ingen evne hos leukocytter til at migrere i henhold til leukocytmigrationsinhiberingsreaktionen (LMIC), og en kraftig stigning i permeabiliteten af lymfocytmembraner afsløres ifølge resultaterne af deres undersøgelser ved hjælp af en fluorescerende tetracyklin-probe.
Hvis fluorescensindekserne for lymfocytter hos raske mennesker er 9,9 ± 2 %, og de ved typisk hepatitis B med et godartet forløb stiger til 22,3 ± 2,7 %, når antallet af fluorescerende lymfocytter i maligne former et gennemsnit på 63,5 ± 5,8 %. Da en stigning i cellemembranernes permeabilitet entydigt vurderes i litteraturen som en pålidelig indikator for deres funktionelle underlegenhed, kan det konkluderes, at der ved hepatitis B, især i den maligne form, er grov skade på lymfocytterne. Dette fremgår også af indekserne for K-celle-cytotoksicitet. I en alvorlig form, i den 1.-2. uge af sygdommen, er cytotoksiciteten 15,5 ± 8,8 %, og i den maligne form i den 1. uge - 6,0 ± 2,6, i den 2. - 22,0 ± 6,3 % med en norm på 44,8 ± 2,6 %.
De præsenterede data indikerer tydeligt udtalte forstyrrelser i den cellulære forbindelse af immunitet hos patienter med alvorlige former for hepatitis B. Det er også tydeligt, at disse ændringer forekommer sekundært som følge af skade på immunkompetente celler forårsaget af toksiske metabolitter og muligvis cirkulerende immunkomplekser.
Som undersøgelser har vist, falder titeren af HBsAg og HBeAg i blodserum hos patienter med alvorlige former for hepatitis B, især i tilfælde af udvikling af massiv levernekrose, og samtidig begynder antistoffer mod overfladeantigenet at blive detekteret i høje titere, hvilket er fuldstændig ukarakteristisk for godartede former af sygdommen, hvor anti-HBV kun optræder i 3.-5. måned af sygdommen.
Den hurtige forsvinden af hepatitis B-virusantigener med samtidig forekomst af høje titere af antivirale antistoffer antyder den intensive dannelse af immunkomplekser og deres mulige deltagelse i patogenesen af udviklingen af massiv levernekrose.
Således tillader de faktuelle materialer os ikke at fortolke hepatitis B entydigt udelukkende ud fra et immunopatologisk aggressionssynspunkt. Og pointen er ikke blot, at der ikke findes nogen sammenhæng mellem dybden og forekomsten af morfologiske ændringer i leveren på den ene side og sværhedsgraden af cellulære immunitetsfaktorer på den anden. Teoretisk set kunne denne omstændighed forklares med de sene stadier af studiet af cellulære immunitetsindikatorer, hvor immunkompetente celler blev udsat for kraftige toksiske effekter på grund af stigende funktionel insufficiens i leveren. Det kan naturligvis antages, at immuncytolyse af hepatocytter forekommer i de tidligste stadier af den infektiøse proces, muligvis endda før forekomsten af kliniske symptomer på alvorlig leverskade. En sådan antagelse er dog usandsynlig, da lignende indikatorer for cellulær immunitet blev påvist hos patienter med det mest akutte (lyn) forløb af sygdommen, og desuden blev der under morfologisk undersøgelse af levervæv ikke påvist massiv lymfocytisk infiltration, mens der samtidig blev påvist kontinuerlige felter af nekrotisk epitel uden fænomener som resorption og lymfocytisk aggression.
Det er meget vanskeligt at forklare det morfologiske billede af akut hepatitis udelukkende ud fra immuncellulær cytolyse, derfor blev den cytotoksiske effekt af hepatitis B-virus ikke udelukket i tidlige studier.
I øjeblikket er denne antagelse delvist bekræftet af opdagelsen af hepatitis B-virus. Som undersøgelser har vist, er hyppigheden af påvisning af hepatitis D-markører direkte afhængig af sygdommens sværhedsgrad: i milde former påvises de hos 14%, moderate - hos 18%, svære - hos 30% og maligne - hos 52% af patienterne. I betragtning af at hepatitis D-virus har en nekrosogen cytopatisk effekt, kan det betragtes som fastslået, at coinfektion med hepatitis B- og D-virus er af stor betydning i udviklingen af fulminante former for hepatitis B.
Patogenesen af hepatitis B kan præsenteres som følger. Efter hepatitis B-virussens indtrængen i hepatocytter induceres et immunologisk angreb på de inficerede hepatocytter af T-dræbere, som udskiller lymfotoksiner i retning af leverceller.
De intime mekanismer for leverskader ved hepatitis B er endnu ikke blevet fastslået. Den ledende rolle spilles af aktiverede processer med lipidperoxidation og lysosomale hydrolaser. Udløseren kan være lymfotoksiner frigivet fra effektorceller ved deres kontakt med hepatocytter, men det er muligt, at virussen selv kan være initiatoren af peroxidationsprocesser. Derefter udvikler den patologiske proces sig sandsynligvis i følgende rækkefølge.
- Interaktion mellem aggressionsfaktoren (lymfotoksiner eller virus) og biologiske makromolekyler (muligvis med komponenter i det endoplasmatiske retikulums membraner, der er i stand til at deltage i afgiftningsprocesser, analogt med andre skadelige stoffer, som det blev vist i forbindelse med kulstoftetrachlorid).
- Dannelse af frie radikaler, aktivering af lipidperoxidationsprocesser og øget permeabilitet af alle hepatocellulære membraner (cytolysesyndrom).
- Bevægelse af biologisk aktive stoffer langs koncentrationsgradienten - tab af enzymer fra forskellige intracellulære lokaliseringer, energidonorer, kalium osv. Akkumulering af natrium og calcium i celler, skift i pH mod intracellulær acidose.
- Aktivering og frigivelse af lysosomale hydrolaser (RNAse, DNAse, cathepsiner osv.) med nedbrydning af leverceller og frigivelse af autoantigener.
- Stimulering af T- og B-immunsystemerne med dannelse af specifik sensibilisering af T-lymfocytter til leverlipoprotein, samt dannelse af antihepatiske humorale autoantistoffer.
I den foreslåede ordning for hepatitis B-patogenese er den udløsende faktor virale antigener, hvis intensive produktion observeres i de tidligste stadier af sygdommen og i hele den akutte periode, med undtagelse af maligne former, hvor produktionen af virale antigener praktisk talt ophører på tidspunktet for udvikling af massiv levernekrose, hvilket forudbestemmer et hurtigt fald i viral replikation.
Det er også tydeligt, at virale antigener aktiverer immunitetens T- og B-systemer. Under denne proces sker der en karakteristisk omfordeling af T-lymfocyt-subpopulationer, der har til formål at organisere et tilstrækkeligt immunrespons, eliminere inficerede hepatocytter, neutralisere virale antigener, sanogenese og helbredelse.
Når immunkompetente celler interagerer med virale antigener på hepatocytmembraner eller under virusreproduktion inde i en hepatocyt, opstår der betingelser for aktivering af lipidperoxidationsprocesser, som, som bekendt, kontrollerer permeabiliteten af alle cellulære og subcellulære membraner.
Fra denne position bliver forekomsten af cytolysesyndrom, en øget permeabilitet af cellemembraner, som er så naturlig og meget karakteristisk for viral hepatitis, forståelig.
Det endelige resultat af cytolysesyndrom kan være fuldstændig afkobling af oxidativ fosforylering, lækage af cellulært materiale og død af leverparenkym.
I langt de fleste tilfælde udvikler disse processer sig dog ikke så fatalt. Kun i ondartede former af sygdommen forløber den patologiske proces lavineagtigt og irreversibelt, da der forekommer massiv infektion, en udtalt immunproces, overdreven aktivering af peroxidationsprocesser og lysosomale hydrodaser samt autoimmune aggressionsfænomener.
De samme mekanismer observeres ved hepatitis B's gunstige forløb, med den eneste ejendommelighed, at de alle realiseres på et kvalitativt forskelligt niveau. I modsætning til tilfælde af massiv levernekrose er antallet af inficerede hepatocytter, og dermed zonen for immunopatologisk cytolyse, mindre ved sygdommens gunstige forløb, lipidperoxidationsprocesserne er ikke så signifikant forstærket, aktiveringen af syrehydrolaser fører kun til begrænset autolyse med en ubetydelig frigivelse af autoantigener, og derfor, uden massiv autoaggression, dvs. alle stadier af patogenesen ved det gunstige forløb udføres inden for rammerne af den bevarede strukturelle organisation af leverparenkym og begrænses af forsvarssystemer (antioxidanter, inhibitorer osv.) og har derfor ikke en så destruktiv effekt.
Årsagerne til forgiftningssymptomer ved viral hepatitis er ikke fuldt ud undersøgt. Forslaget om at skelne mellem den såkaldte primære eller virale forgiftning og sekundær (udveksling eller metabolisk) kan betragtes som positivt, selvom dette ikke afslører den intime mekanisme for forekomsten af generelt toksisk syndrom. For det første har hepatitisvirus ikke toksiske egenskaber, og for det andet korrelerer koncentrationen af mange metabolitter ikke altid med sygdommens sværhedsgrad og graden af ekspression af toksikosesymptomer. Det er også kendt, at koncentrationen af virale antigener ikke strengt korrelerer med forgiftningens sværhedsgrad. Tværtimod falder koncentrationen af HBsAg med en stigning i sygdommens sværhedsgrad og dermed stigningen i graden af toksikose og er lavest i maligne former på tidspunktet for indtræden af dyb leverkoma. Samtidig afhænger hyppigheden af detektering og titere af specifikke antivirale antistoffer direkte af sygdommens sværhedsgrad.
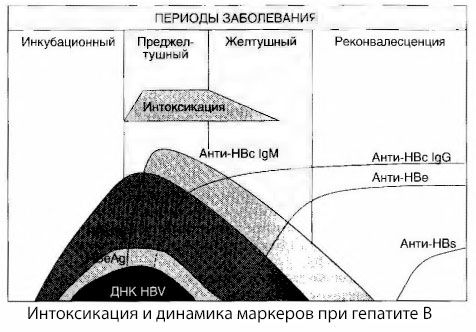
Forgiftning opstår ikke i det øjeblik, hvor virale antigener registreres, men i løbet af den periode, hvor antivirale antistoffer af klasse IgM mod ko-antigenet og antigenet i E-systemet cirkulerer i blodet. Desuden har en betydelig andel af patienterne i alvorlige og især maligne former endda anti-HB'er i blodet, hvilket normalt aldrig observeres i milde og moderate former af sygdommen.
De præsenterede data tillader os at konkludere, at toksikosesyndromet ved viral hepatitis, og især hepatitis B, ikke opstår som følge af forekomsten af virale antigener i blodet, men er en konsekvens af interaktionen mellem virale antigener og antivirale antistoffer af IgM-klassen. Resultatet af en sådan interaktion er, som bekendt, dannelsen af immunkomplekser og muligvis aktive toksiske stoffer.
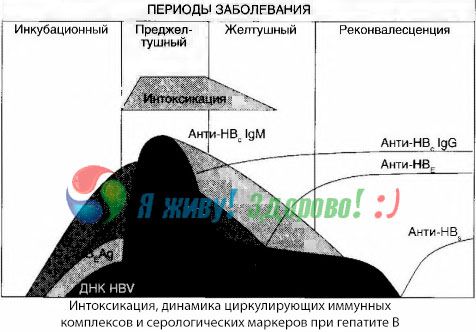
Symptomer på forgiftning opstår i det øjeblik, immunkomplekser opstår i fri cirkulation, men efterfølgende observeres en sådan korrelation ikke.
En delvis forklaring på dette kan findes i studiet af immunkompleksers sammensætning. Hos patienter med svære former cirkulerer overvejende mellemstore komplekser i blodet, og i deres sammensætning dominerer antistoffer af klassen på højdepunktet af det toksiske syndrom, hvorimod komplekserne bliver større i perioden med fald i kliniske manifestationer og rekonvalescens, og i deres sammensætning begynder antistoffer af IgG-klassen at dominere.
De præsenterede data vedrører mekanismerne for udvikling af toksisk syndrom i sygdommens indledende periode, men ved toksikose, der opstår på højdepunktet af de kliniske manifestationer, har de kun delvis betydning, især ved udvikling af hepatisk koma.
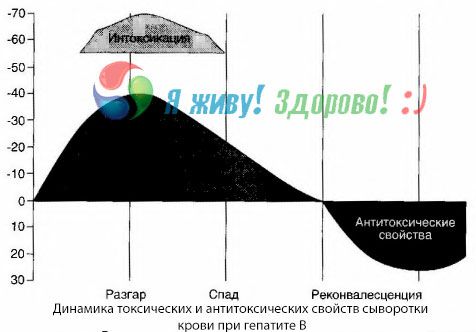
Blodkulturmetoden har vist, at der ved hepatitis B konstant ophobes toksiner i blodet, som frigives fra det beskadigede, nedbrydende levervæv. Koncentrationen af disse toksiner er proportional med sygdommens sværhedsgrad, de er af proteinagtig natur.
I løbet af rekonvalescensperioden vises antistoffer mod dette toksin i blodet; men i tilfælde af leverkoma stiger koncentrationen af toksinet i blodet kraftigt, og der detekteres ingen antistoffer i blodet.
Patomorfologi af hepatitis B
Baseret på arten af morfologiske ændringer skelnes der mellem tre former for akut hepatitis B:
- cyklisk form,
- massiv levernekrose;
- kolestatisk pericholangiolytisk hepatitis.
Ved den cykliske form af hepatitis B er dystrofiske, inflammatoriske og proliferative forandringer mere udtalte i midten af lobulerne, mens de ved hepatitis A er lokaliseret langs lobulens periferi og spreder sig til midten. Disse forskelle forklares af forskellige veje for viruspenetration ind i leverparenkym. Hepatitis A-virus trænger ind i leveren gennem portvenen og spreder sig til midten af lobulerne, mens hepatitis B-virus trænger gennem leverarterien og kapillærgrenene, der forsyner alle lobulerne jævnt helt op til deres centrum.
Graden af skade på leverparenkym svarer i de fleste tilfælde til sværhedsgraden af sygdommens kliniske manifestationer. I milde former observeres normalt fokal nekrose af hepatocytter, og i moderate og svære former - zonal nekrose (med en tendens til at fusionere og danne brolignende nekrose i svære former af sygdommen).
De største morfologiske ændringer i parenkymet observeres på højdepunktet af de kliniske manifestationer, hvilket normalt falder sammen med sygdommens første årti. I løbet af det 2. og især det 3. årti intensiveres regenereringsprocesserne. I denne periode forsvinder nekrobiotiske ændringer næsten fuldstændigt, og cellulære infiltrationsprocesser begynder at dominere med en langsom efterfølgende genoprettelse af strukturen af de hepatocellulære plader. Imidlertid sker en fuldstændig genoprettelse af leverparenkymets struktur og funktion først 3-6 måneder efter sygdommens debut og ikke hos alle patienter.
Den generaliserede karakter af infektionen i hepatitis B bekræftes ved påvisning af HBsAg ikke kun i hepatocytter, men også i nyrer, lunger, milt, bugspytkirtel, knoglemarvsceller osv.
Kolestatisk (perikolangiolytisk) hepatitis er en særlig form for sygdommen, hvor de største morfologiske ændringer findes i de intrahepatiske galdegange, med et billede af kolangiolitis og perikolangiolitis. I den kolestatiske form forekommer kolestase med udvidelse af galdekapillærerne med stase af galde i dem, med proliferation af kolangiole og cellulære infiltrater omkring dem. Leverceller påvirkes ubetydeligt i denne form for hepatitis. Klinisk er sygdommen karakteriseret ved et langvarigt forløb med forlænget gulsot. Det har vist sig, at årsagen til et sådant særegent sygdomsforløb er virussens dominerende effekt på kolangiolens vægge med en ubetydelig effekt på hepatocytter.

