Medicinsk ekspert af artiklen
Nye publikationer
Eksperimentelle modeller af slidgigt
Sidst revideret: 07.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Brusk er et højt specialiseret væv, der kun indeholder én type celler (chondrocytter) og er karakteriseret ved fraværet af blod og lymfekar. Brusk næres hovedsageligt ved absorption fra synovialvæsken. Chondrocytmetabolisme reguleres af en række opløselige faktorer, der produceres lokalt af chondrocytter og omgivende væv. Chondrocytfunktionen afhænger også af sammensætningen af det ekstracellulære miljø (iltspænding, ionkoncentration, pH osv.), sammensætningen af ECM, interaktionen mellem celler og matrix samt fysiske signaler. Hovedformålet med eksperimentel modellering er at skabe kulturer i det ekstracellulære miljø uden at ændre fænotypen af modne celler. Det andet mål er at skabe kulturer for at studere chondrocytters for tidlige, forsinkede, kortvarige eller forlængede respons på kemiske og/eller fysiske signaler. In vitro-studier giver også mulighed for at studere chondrocytters adfærd ved slidgigt. Det tredje mål er at udvikle samkultursystemer, der gør det muligt at studere interaktionerne mellem forskellige væv i leddet. Den fjerde opgave er forberedelse af bruskimplantater til efterfølgende transplantation. Og endelig er den femte opgave studiet af vækstfaktorer, cytokiner eller terapeutiske midler, der er i stand til at stimulere reparation og/eller hæmme bruskresorption.
I løbet af de seneste årtier er der blevet skabt forskellige modeller af ledbruskcellekulturer, herunder monolagskulturer, suspenderede kulturer, kondronkulturer, eksplantater, samkulturer og udødelige cellekulturer. Hver kultur har sine egne fordele og ulemper, og hver er egnet til at studere et specifikt aspekt af kondrocytmetabolisme. Bruskeksplanter er således en fremragende model til at studere omsætningen af matrixelementer, hvilket kræver ægte celleoverfladereceptorer og normale celle-matrix- og matrix-celle-interaktioner. Samtidig anbefales det at studere matrixaflejringer eller mekanismer, der regulerer kondrocytmetabolisme, på en kultur af isolerede celler. En lavdensitets monolagskultur er nødvendig for at studere processen med celledifferentiering. Kulturer suspenderet i en naturlig eller syntetisk matrix er en model til at analysere kondrocytters adaptive respons på mekanisk stress.
Chondrocytkulturer
Flere vigtige punkter bør tages i betragtning ved udvælgelse af bruskvæv til in vitro-studier. Matrixsammensætningen og den metaboliske aktivitet af chondrocytter varierer mellem led, og sidstnævnte afhænger også af dybden af chondrocytternes placering i vævet. Disse data blev opnået i adskillige eksperimenter, hvor isolerede chondrocyttersubpopulationer fra bruskzoner i forskellige dybder blev undersøgt. En række morfologiske og biokemiske forskelle blev fundet mellem dyrkede chondrocytter placeret i de overfladiske og dybe lag af ledbrusk. Overfladiske celler syntetiserer en sparsom, proteoglykanfattig fibrillær matrix, hvorimod dybereliggende celler producerer en matrix rig på fibriller og proteoglykaner. Desuden producerer overfladiske celler relativt flere små ikke-aggregerede proteoglykaner og hyaluronsyre og relativt mindre aggrecan og keratansulfat end dybereliggende chondrocytter. Et andet vigtigt karakteristisk træk ved metabolismen af chondrocytter isoleret fra bruskzoner i forskellige dybder er responsen på en eksogen stimulus. Ifølge M. Aydelotte et al. var bovine kondrocytter fra den overfladiske zone af brusk mere følsomme over for IL-1 end celler fra den dybe zone.
Celleadfærd afhænger også af vævets placering. Kondrocytter fra ribben- og ørebrusk fra det samme dyr reagerer forskelligt på vækstfaktorer såsom fibroblastvækstfaktor (FGF) og TGF-beta. FGF øgede inkorporeringen af thymidin, prolin og leucin i dyrkede ribben, men ikke i ørekondrocytter. TGF-beta øgede inkorporeringen af thymidin i ribben- og ørebruskkondrocytter, men havde ingen effekt på inkorporeringen af thymidin og prolin i ørekondrocytter. Bruskceller fra områder med høj stress adskiller sig fra dem fra områder med lav stress på brusken. Således syntetiserer kondrocytter fra knæledsbrusk fra modne får fra den centrale region af skinnebenets ledflade, der ikke er dækket af menisken, som bærer den største belastning in vivo, mindre aggrecan, men mere decorin end celler fra de zoner, der er dækket af menisken. Forfatterne understreger også vigtigheden af at bruge brusk fra identiske ledzoner, når man studerer den syntetiske funktion af led.
Kondrocytters metabolisme og deres respons på regulatoriske faktorer afhænger også i væsentlig grad af donorens alder, deres skeletudvikling og tilstanden af de led, hvorfra cellerne tages. I humane kondrocytter observeres et signifikant fald i den proliferative respons med alderen. Det største fald observeres hos donorer i alderen 40-50 år og over 60 år. Desuden falder sværhedsgraden af den proliferative respons på vækstfaktorer (f.eks. FGF og TGF-beta) med aldring. Ud over kvantitative ændringer i kondrocytproliferation er der også kvalitative ændringer. Celler fra unge donorer (10-20 år) reagerer bedre på blodpladeafledt vækstfaktor (PDGF) end på TGF-beta, mens det modsatte observeres i celler fra voksne donorer. Flere mekanismer bruges til at forklare aldersafhængige ændringer i kondrocytters syntetiske funktion og deres respons på vækstfaktorer. Disse omfatter et fald i antallet og affiniteten af overfladecellereceptorer, ændringer i syntesen og bioaktiviteten af vækstfaktorer og cytokiner samt modifikation af post-receptorsignaler.
Leddens patologiske tilstand ændrer også morfologi og metabolisk aktivitet af chondrocytter. J. Kouri et al. (1996) identificerede således tre underpopulationer af chondrocytter i brusk ved slidgigt. Chondrocytter fra den overfladiske og øvre del af midten af brusken danner klynger og syntetiserer en større mængde proteoglykaner og kollagen. TGF-beta og insulinlignende vækstfaktor (IGF) er i stand til at stimulere syntesen af proteoglykaner af chondrocytter og delvist neutralisere virkningerne af IL-1 og TNF-α. Eksplanter af brusk påvirket af slidgigt og chondrocytter isoleret fra brusken hos en patient med slidgigt er mere følsomme over for stimulering af TGF-beta end chondrocytter fra sund brusk. Disse forskelle er sandsynligvis forbundet med fænotypiske ændringer i chondrocytter i de øvre lag af ledbrusk.
Isolering af individuelle chondrocytter opnås ved sekventiel behandling af ECM med proteolytiske enzymer. Efter deres frigivelse fra ECM er de isolerede celler ideelle til at studere de novo syntesen af matrixkomponenter. Nogle forfattere bruger kun clostridial collagenase, mens andre præinkuberer brusken med trypsin, pronase, DNase og/eller hyaluronidase. Antallet af isolerede celler afhænger af de anvendte enzymer. Når der kun behandles med collagenase, kan 1,4-106 chondrocytter således opnås fra 1 g væv, mens der anvendes pronase, hyaluronidase og collagenase - 4,3-106 . Når der behandles med collagenase, forbliver aggrecan, proteiner, IL-6 og IL-8 i cellekulturen i betydeligt større mængder end ved sekventiel behandling med forskellige enzymer. Der er flere forklaringer på disse forskelle mellem de to cellekulturer:
- Cellereceptorer beskadiges eller hæmmes af enzymer, mens TGF-beta hæmmer DNA- og proteoglykansyntese i frisk isolerede chondrocytter (dag 1), hvorimod DNA- og proteoglykansyntese i chondrocytter dyrket i et monolag (7 dage) stimuleres af TGF-beta. Der kræves dog en tilstrækkelig periode til reekspression af disse membrankomponenter, før eksperimentet påbegyndes.
- Eksogene proteaser kan forstyrre den integrin-medierede celle-matrix-interaktion. Integrinfamilien fremmer chondrocytters binding til ECM-molekyler (Shakibaei M. et al., 1997). Denne forstyrrelse kan påvirke ekspressionen af matrixgener.
- Resterne af matrixkomponenter kan regulere chondrocytternes syntetiske funktion. Integriner er i stand til at genkende produkterne af ECM-nedbrydning og spiller dermed en vigtig rolle i vævsreparation efter proteolytiske enzymers virkning. T. Larsson et al. (1989) rapporterede, at tilsætning af intakte eller fragmenterede proteoglykaner til cellekultur stimulerer syntesen af proteiner og proteoglykaner. Imidlertid forårsager et højt niveau af hyaluronsyre et signifikant fald i inklusionen af sulfater i syntesen af proteoglykaner af chondrocytter i kyllingefosteret, modne chondrocytter i grise- og rotte-kondrosarkomceller. Desuden er hyaluronsyre en hæmmer af proteoglykanfrigivelse fra celler, selv i nærvær af IL-1b, TNF-a, FGF, hvilket indikerer modvirkning af den første biologiske aktivitet af vækstfaktorer og cytokiner. Den nøjagtige mekanisme, der ligger til grund for hyaluronsyres virkning, forbliver uklar; chondrocytter vides at indeholde en receptor for hyaluronsyre forbundet med aktinfilamenter i cytosolen. Binding af hyaluronsyre til dens receptor stimulerer proteinfosforylering. Disse data demonstrerer således modulering af chondrocytternes metaboliske funktion af fragmenterede eller native molekyler af matrixproteiner gennem aktivering af cellemembranreceptorer.
- Hurtig stimulering af matrixproteinsyntese af kondrocytter af enzymer kan være en konsekvens af ændringer i kondrocytternes form og/eller cytoskeletets reorganisering.
- Nogle cytokiner (f.eks. IL-8) og vækstfaktorer (f.eks. IGF-1, TGF-β) er sekvestreret i ECM. Det mest kendte eksempel er bindingen af TGF-β af decorin, hvilket resulterer i en nedsat evne hos førstnævnte til at inducere cellevækst i ovarieceller fra kinesiske hamstere. Fundet af, at decorinindholdet i brusk stiger med alderen, tyder på et fald i TGF-β-biotilgængelighed med aldring. Vækstfaktorer og cytokiner kan frigives fra matrixrester under dyrkning og efterfølgende modulere kondrocytfunktionen.
Monolagskultur af chondrocytter
Den differentierede fænotype af chondrocytter er primært karakteriseret ved syntesen af type II-kollagen og vævsspecifikke proteoglykaner, samt et lavt niveau af mitotisk aktivitet. Der er tegn på, at chondrocytter med langvarig celledyrkning i et monolag, såvel som efter flere gentagne cellepassager, mister deres sfæriske konturer og får en aflang, fibroblastlignende form. Med sådan fibroblastisk metaplasi ændres også cellernes syntetiske funktion, karakteriseret ved et progressivt fald i syntesen af kollagener type II, IX og XI og en stigning i syntesen af kollagener type I, III og Y. Små ikke-aggregerede proteoglykaner syntetiseres på grund af funktionel aggrecan. Syntesen af cathepsin B og L er ekstremt lav i differentierede celler, men øges i processen med tab af differentiering. Kollagenase-1 udtrykkes i differentierede chondrocytter; med langvarig dyrkning falder dens ekspression, mens produktionen af vævsinhibitorer af metalloproteaser (TIMP'er) øges.
Differentierede chondrocytter genudtrykker kollagen af den differentierede fænotype, når de overføres fra monolag til suspenderet kultur. Differentieringsprocessen er sandsynligvis relateret til celleformen. Denne egenskab anvendes regelmæssigt af forskere, der studerer defekte transplantater med autologe chondrocytter. Et lille antal celler opnået fra biopsimateriale kan ekspanderes i monolagskultur og derefter genintroduceres i en tredimensionel matrix før transplantation. Genudtryk af en specifik fænotype af dedifferentierede chondrocytter overført til agarosekultur kan stimuleres af TGF-β, ossein-hydroxyapatitkompleks og ascorbinsyre.
Som reaktion på vækstfaktorer og cytokiner modificeres chondrocytter under differentieringsprocessen. Den cellulære reaktion på cytokiner og vækstfaktorer varierer mellem udifferentierede og differentierede chondrocytter. IL-1 stimulerer fibroblastproliferation, hvorimod væksten af udifferentierede chondrocytter hæmmes af IL-1. DNA-syntese stimuleres af IGF-1 i aflange, men ikke flade chondrocytter. I differentierede chondrocytter er de stimulerende virkninger af IL-1beta og TNF-α på procollagenaseproduktion mere udtalte end i udifferentierede chondrocytter.
Dyrkning af kondrocytter
Dyrkning af kondrocytter i suspension i et flydende medium eller i en naturlig eller syntetisk tredimensionel matrix stabiliserer kondrocytternes fænotype. Cellerne bevarer deres sfæriske form og syntetiserer vævsspecifikke proteiner. Suspenderet kultur af kondrocytter anbefales normalt til undersøgelse af dannelsen af en ny pericellulær matrix. Kulturer af kondrocytter i syntetiske eller naturlige absorberende polymerer anvendes til implantation af celler i bruskdefekter for at stimulere regenerering af ledbruskvæv. Det syntetiske eller naturlige medium til implanterede celler skal opfylde en række krav:
- Implantater skal have en porøs struktur for celleadhæsion og vækst,
- Hverken selve polymeren eller dens nedbrydningsprodukter bør forårsage inflammation eller toksiske reaktioner ved implantat in vivo,
- Transplantatbæreren skal have evnen til at binde sig til tilstødende brusk eller subkondral knogle,
- Den naturlige eller syntetiske matrix skal have evnen til at absorbere, og dens nedbrydning skal afbalanceres af vævsregenerering,
- For at lette bruskreparation skal matrixens kemiske struktur og porearkitektur fremme opretholdelsen af den cellulære fænotype og syntesen af vævsspecifikke proteiner af de chondrocytter, der er placeret i den,
- Under in vivo-implantation er det nødvendigt at undersøge de mekaniske egenskaber af den syntetiske eller naturlige matrix.
 [ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
[ 12 ], [ 13 ], [ 14 ], [ 15 ], [ 16 ]
Suspension af chondrocytter i flydende fase
Cellers binding til plastikkar, hvori chondrocytter dyrkes, kan forhindres ved at belægge deres vægge med en opløsning af methylcellulose, agarose, hydrogel (poly-2-hydroxyethylmethacrylat) eller en kollagen-agaroseblanding. Under disse forhold danner chondrocytter klynger og syntetiserer primært aggrecan og vævsspecifikke kollagener (II, IX, XI typer). Der findes normalt to typer celler. Cellerne i midten bevarer en sfærisk form og er omgivet af en veludviklet ECM, hvilket bekræftes af histokemiske og ultrastrukturelle undersøgelser. I periferien har chondrocytter diskoide konturer og er omgivet af en sparsom ECM; der vides kun lidt om de funktionelle egenskaber ved sådanne celler.
Det er muligt at dyrke chondrocytter på mikrobærere, der holdes i suspension; dextrankugler (cytodex), kollagenbelagte dextrankugler (cytodex III) og ikke-porøse mikrosfærer af type I-kollagen (cellagen) anvendes som mikrobærere. Under disse dyrkningsbetingelser binder chondrocytter sig til overfladen af mikrobæreren, bevarer deres sfæriske form og producerer et matrixlignende materiale. Desuden fremmer brugen af cellagen chondrocytterproliferation og reekspression af den normale fænotype. Derfor kan dyrkning af chondrocytter på cellagenmikrosfærer bruges til at genoprette cellefænotypen før transplantation.
En anden metode til dyrkning af kondrocytsuspensioner i et flydende medium er deres dyrkning i form af tætte kugler bestående af celler (0,5-1 * 10 b ), opnået ved centrifugering. Sådanne kondrocytter er i stand til at producere en matrix indeholdende en stor mængde proteoglykaner, kollagen type II, men ikke kollagen type I, hvilket bekræftes ved histologiske, immunhistokemiske og kvantitative metoder.
Suspension af chondrocytter i naturlig ECM
Kondrocytter kan dyrkes i suspension i en tredimensionel matrix (blød agar, agarose, kollagengel eller -svamp, hyaluronsyre, fibrinlim, alginatperler).
Chondrocytter dyrket i agarose bevarer deres normale fænotype og syntetiserer type II-kollagen og vævsspecifikke aggrecanaggregater. Ved dyrkning i agarose frigives proteoglykaner syntetiseret af cellen til mediet i 50 dage. Til sammenligning er cellulær fase i en monolagskultur overfyldt med glycosaminoglycaner allerede i de første 5-6 dage af dyrkningen; ved dyrkning i mediet, efter øget syntese og frigivelse af glycosaminoglycaner i de første 8-10 dage, forekommer deres tidsafhængige fald. Ikke desto mindre adskiller chondrocytters adfærd ved dyrkning i agarose sig fra den in vivo. I agarose indeholder et stort antal syntetiserede aggrecanaggregater mindre molekyler og færre molekyler end in vivo. TGF-β stimulerer proteoglykansyntesen i eksplantatet, men reducerer aggrecansyntesen i agarose.
Alginat er et lineært polysaccharid udvundet af brunt tang. I nærvær af divalente kationer, såsom Ca2 + -ioner, bliver denne polymer til en gel. Hver kondrocyt fanget i alginat er omgivet af en matrix af negativt ladede polysaccharider, hvis porer er sammenlignelige med dem i hyalinbrusk. Matrixen dannet af kondrocytter i alginatkugler består af to rum - et tyndt lag af celleassocieret matrix svarende til den pericellulære og territoriale matrix af ledbrusk og en mere fjern matrix svarende til den interterritoriale i nativt væv. På den 30. dag af dyrkningen er det relative og absolutte volumen optaget af cellerne og hvert af de to rum i en alginatkugle næsten fuldstændig identisk med dem i nativ brusk. I næsten 30 dage bevarer kondrocytter deres sfæriske form og producerer aggrecan, hvis hydrodynamiske egenskaber ligner dem af aggrecanmolekyler i ledbruskmatrixen, såvel som kollagenmolekyler af type II, IX og XI. Samtidig, ligesom andre suspensionskulturer, er der flade celler til stede på overfladen af alginatkugler, som producerer en lille mængde kollagenmolekyler af type I, som frigives direkte til mediet og ikke inkorporeres i ECM. Moderat proliferation af chondrocytter observeres i alginatkugler. Efter 8 måneders dyrkning i alginatgel mister modne chondrocytter ikke metabolisk aktivitet og fortsætter med at syntetisere vævsspecifikt kollagen type II og aggrecan.
H. Tanaka et al. (1984) undersøgte diffusionsegenskaberne af forskellige naturlige molekyler i alginat og fandt, at molekyler større end 70 kDa ikke diffunderede gennem alginat. Cellekultur i alginat er derfor egnet til at studere reguleringen af matrixbiosyntese og ECM-organisation. Tilgængeligheden af celler dyrket i alginat gør det muligt at studere virkningen af peptidregulerende faktorer og farmakologiske midler på transkriptionelt, posttranskriptionelt og translationelt niveau.
Chondrocytter dyrkes også i en matrix af kollagenfibre af type I og II. S. Nehrer et al. (1997) sammenlignede funktionen af hundechondrocytter i porøse kollagen-proteoglykan-polymermatricer indeholdende kollagener af forskellige typer. De fandt vigtige forskelle i morfologien af den biosyntetiske funktion af chondrocytter dyrket i kollagenmatricer indeholdende kollagen af type I og II. Celler i en matrix af kollagen type II beholdt deres sfæriske form, mens de i kollagen type I havde en fibroblastlignende morfologi. Desuden producerede chondrocytter i en matrix af kollagen type II en større mængde glycosaminoglykaner. J. van Susante et al. (1995) sammenlignede egenskaberne af chondrocytter dyrket i alginat og kollagen (type I) gel. Forfatterne fandt en signifikant stigning i antallet af celler i kollagengelen, men fra den 6. dyrkningsdag mistede cellerne deres karakteristiske fænotype og blev til fibroblastlignende celler. I alginatgelen observeredes et fald i antallet af celler, men kondrocytter beholdt deres normale fænotype. I kollagengelen var antallet af proteoglykaner pr. celle signifikant højere end i alginat, men i gelen observeredes et fald i syntesen af matrixelementer, startende fra den 6. dyrkningsdag, mens syntesen i alginat fortsatte med at stige.
En fast tredimensionel fibrinmatrix er et naturligt stof, der understøtter kondrocytter suspenderet i den i en differentieret fænotype. Tredimensionel fibrinmatrix kan også bruges som bærer ved kondrocyttransplantation. Fordelene ved fibrin er fraværet af cytotoksicitet, evnen til at fylde rum og adhæsionsevnen. Histologiske og biokemiske undersøgelser, autoradiografi og elektronmikroskopi har vist, at kondrocytter i fibringel bevarer deres morfologi, prolifererer og producerer matrix selv efter 2 ugers dyrkning. G. Homminga et al. (1993) rapporterede imidlertid, at fibrin-disintegration begynder efter 3 dages dyrkning, og at kondrocyt-dedifferentieringen skrider frem.
Suspension af chondrocytter i kunstig (syntetisk) ECM
Brusimplantater til rekonstruktiv eller ortopædisk kirurgi kan fremstilles ved at dyrke isolerede kondrocytter in vitro i en syntetisk biokompatibel matrix.
Kondrocytter dyrket i polyglykolsyre prolifererer og opretholder normal morfologi og fænotype i 8 uger. Kondrocytter-polyglykolsyrekomplekset består af celler, glycosaminoglykaner, kollagener og har en ekstern kollagenkapsel. Sådanne implantater indeholder dog to typer kollagenmolekyler - I og II. Implantater fra kondrocytter, der er dedifferentieret ved en række passager, har en større mængde glycosaminoglykaner og kollagener end implantater fra primært udifferentierede kondrocytter.
L. Freed et al. (1993b) sammenlignede adfærden af humane og bovine kondrocytter i fibrøs polyglykolsyre (FPGA) og porøs polymælkesyre (PPLA). Efter 6-8 ugers dyrkning af bovine kondrocytter i FPGA eller PPLA observerede forfatterne celleproliferation og regenerering af bruskmatrixen. I FPGA havde kondrocytterne en sfærisk form og var placeret i lakuner omgivet af en bruskmatrix. Efter 8 ugers in vitro-dyrkning indeholdt det regenererede væv op til 50% tørstof (4% cellemasse, 15% glycosaminoglycaner og 31% kollagener). I PPLA havde cellerne en spindelformet form og en lille mængde glycosaminoglycaner og kollagen. I FPGA var cellevæksten 2 gange mere intens end i PPLA. In vivo producerede kondrocytter dyrket i VPGK og PPLC væv, der histologisk lignede brusk, inden for 1-6 måneder. Implantaterne indeholdt glycosaminoglycaner, kollagener type I og II.
Bovine føtale kondrocytter blev dyrket i porøs hydrofob og hydrofil polyethylen med høj densitet. Efter 7 dages inkubation i begge substrater beholdt cellerne en sfærisk form og indeholdt hovedsageligt type II-kollagen. Efter 21 dages dyrkning viste det sig, at den hydrofile matrix indeholdt mere type II-kollagen end den hydrofobe matrix.
Bruskvæv kan også udvindes ved dyrkning i et monolag på Millicell-CM-filtre. Forbelægning af filtrene med kollagen er nødvendig for hæftning af chondroitiner. Histologisk undersøgelse af kulturen viser akkumulering af chondrocytter i ECM indeholdende proteoglykaner og type II-kollagen. Type I-kollagen blev ikke påvist i en sådan kultur. Chondrocytter i det opnåede bruskvæv er sfæriske i form, men på overfladen af vævet er de noget flade. Tykkelsen af det nydannede væv steg med tiden og afhang af cellemonolagets initiale tæthed. Under optimale dyrkningsbetingelser nåede bruskvævets tykkelse 110 μm, og organiseringen af dets celler og kollagen i overfladiske og dybe lag svarer til ledbrusk. ECM indeholder cirka 3 gange mere kollagen og proteoglykaner. Efter 2 ugers dyrkning blev der observeret matrixakkumulering, hvilket gjorde det muligt at ekstrahere vævet fra filteret og bruge det til transplantation.
Sims et al. (1996) undersøgte dyrkning af kondrocytter i polyethylenoxidgel, en indkapslet polymermatrix, der muliggør overførsel af et stort antal celler ved injektion. Seks uger efter injektion i det subkutane væv hos atymiske mus blev der dannet ny brusk, som morfologisk var karakteriseret ved en hvid opalescens svarende til hyalinbrusk. Histologiske og biokemiske data indikerede tilstedeværelsen af aktivt prolifererende kondrocytter, der producerer ECM.
Eksplantning
Eksplantation af bruskvæv bruges til at studere processerne for ana- og katabolisme i det, opretholdelse af homeostase, resorption og reparation. Kondrocytter i bruskeksplantater opretholder en normal fænotype og ECM-sammensætning svarende til dem i ledbrusk in vivo. Efter 5 dages dyrkning i nærvær af serum opnås et konstant niveau af syntese og naturlige nedbrydningsprocesser. Vævsresorption kan accelereres i hovedkulturen og i kultur ved tilsætning af serum ved hjælp af en række midler, såsom IL-IB, TNF-a, bakterielle lipopolysaccharider, retinsyrederivater eller aktive iltradikaler. For at studere bruskreparation induceres dets skade af opløselige inflammatoriske mediatorer (H2O2 , IL 1, TNF-a) eller fysisk ruptur af matrixen.
Den organotypiske dyrkningsmetode er en model til in vitro-studier af virkningerne af isolerede eksterne faktorer på chondrocytter og den omgivende matrix. In vivo er chondrocytter spredt placeret i ECM og er ikke i kontakt med hinanden. Den artikulære bruskeksplantationskultur bevarer denne strukturelle organisation, såvel som de specifikke interaktioner mellem chondrocytter og det omgivende ekstracellulære miljø. Denne model bruges også til at studere virkningerne af mekanisk stress, farmakologiske stoffer, vækstfaktorer, cytokiner og hormoner på bruskmetabolismen.
En anden fordel ved eksplantation af bruskvæv er fraværet af skader på kondrocytter under påvirkning af proteolytiske enzymer eller mekaniske faktorer, hvilket er uundgåeligt ved isolering af celler. Receptorer og andre membranproteiner og glykoproteiner er beskyttet mod skadelige faktorer.
 [ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
[ 17 ], [ 18 ], [ 19 ], [ 20 ], [ 21 ]
Chondronkultur
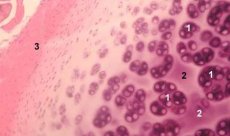
Kondron er en strukturel, funktionel og metabolisk enhed i ledbrusk, der består af en kondrocyt, dens pericellulære matrix og kompakte filamentøse kapsel, og som er ansvarlig for matrixhomeostase. Kondroner ekstraheres mekanisk fra brusk og opsamles ved hjælp af flere successive homogeniseringer ved lav hastighed. Kondroner isoleret fra zoner med forskellige bruskdybder kan opdeles i fire kategorier: enkelt kondron, parrede kondroner, flere (tre eller flere) lineært arrangerede kondroner (kondronsøjler) og kondronklynger.
Enkeltkondroner findes normalt i de midterste lag af intakt brusk, parrede kondroner findes ved grænsen mellem de midterste og dybe lag, og lineært arrangerede multiple kondroner er typiske for de dybe lag af intakt brusk. Endelig består kondronklynger af tilfældigt organiserede grupper af enkelte og parrede kondroner, som bevarer en aggregeret tilstand efter homogenisering. Kondronklynger er store fragmenter af brusk, der normalt indeholder flere kondroner og radialt arrangerede kollagenfibriller, dvs. en typisk organisation, der er karakteristisk for de dybe lag af matrixen. Kondroner er immobiliseret i transparent agarose, hvilket muliggør studier af deres struktur, molekylære sammensætning og metaboliske aktivitet. Kondron-agarosesystemet betragtes som en mikromodel af brusk, der adskiller sig fra det traditionelle kondrocyt-agarosesystem, idet det naturlige mikromiljø bevares, og der ikke er behov for at syntetisere og samle det. Kondronkultur er en model til at studere interaktionerne mellem celler og matrix i ledbrusk under normale og patologiske forhold.
 [ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
[ 22 ], [ 23 ], [ 24 ], [ 25 ], [ 26 ], [ 27 ]
Kultur af udødelige kondrocytter
Rekombinant DNA eller onkogenholdige vira, der er i stand til at gøre en celle "udødelig", bruges til at skabe permanente cellelinjer. Udødelige chondrocytter har evnen til at proliferere uendeligt, samtidig med at de opretholder en stabil fænotype. F. Mallein-Gerin et al. (1995) viste, at SV40T-onkogenet inducerer proliferation af musechondrocytter, som fortsat stabilt udtrykker kollagen type II, IX og XI, såvel som artikulær aggrecan og bindende protein. En sådan cellelinje opnår imidlertid evnen til at syntetisere kollagen type I, når den dyrkes i en monolagskultur eller i en agarosegel.
W. Horton et al. (1988) beskrev en linje af udødelige celler med et lavt niveau af ekspression af type II kollagen mRNA. Disse celler blev opnået ved deres transformation med en museretrovirus indeholdende I-myc- og y-ra-onkogener. Denne celletype repræsenterer en unik model til at studere interaktionerne i den artikulære matrix i fravær af type II kollagen, såvel som reguleringen af type II kollagensyntese.
Kultur af kondropritter med muterede eller deleterede gener er en bekvem model til at studere deres fysiologiske funktion. Denne model er især velegnet til at studere specifikke molekylers rolle i organiseringen af bruskmatrixen eller til at undersøge virkningerne af forskellige regulatoriske faktorer på bruskmetabolismen. Kondrocytter med et deleteret gen for type IX-kollagen syntetiserer kollagenfibriller, der er bredere end normalt, hvilket indikerer, at type IX-kollagen regulerer fibrillernes diameter. Som nævnt i kapitel 1 er en mutation i COLAI-genet, der koder for type II-kollagen, for nylig blevet opdaget i familier med primær generaliseret slidgigt. For at studere effekten af mutant type II-kollagen på den artikulære matrix transficerede R. Dharmrvaram et al. (1997) (inficerede med fremmed nukleinsyre) defekte COL 2 AI (arginin i position 519 er erstattet af cystein) ind i humane føtale kondrocytter in vitro.
Samkultursystem. I leddet interagerer brusk med andre typer celler, der findes i synovialmembranen, synovialvæsken, ledbåndene og den subkondrale knogle. Kondrocytternes metabolisme kan påvirkes af forskellige opløselige faktorer, der syntetiseres af de anførte celler. Ved gigt ødelægges ledbrusk således af proteolytiske enzymer og frie radikaler produceret af synovialceller. Derfor er der udviklet modeller til at studere komplekse interaktioner mellem brusk og omgivende væv, som kaldes samkulturer.
S. Lacombe-Gleise et al. (1995) dyrkede kaninchondrocytter og osteoblaster i et samkultursystem (COSTAR), hvor cellerne var adskilt af en mikroporøs membran (0,4 μm), der muliggjorde udveksling mellem de to celletyper uden direkte kontakt. Denne undersøgelse demonstrerede osteoblasters evne til at stimulere chondrocytvækst via opløselige mediatorer.
AM Malfait og medforfattere (1994) undersøgte forholdet mellem perifere blodmonocytter og kondrocytter. Denne model er bekvem til at studere cytokinmedierede processer i inflammatoriske artropatier (leddegigt, seronegative spondyloartritis osv.). Forfatterne af modellen adskilte cellerne med en proteinbindende membran med porer på 0,4 μm i diameter. Undersøgelsen viste, at monocytter stimuleret med lipopolysaccharid producerede IL-1 og TNF-α, hvilket hæmmede syntesen af aggrecan af kondrocytter og bidrog til nedbrydningen af allerede syntetiserede aggrecanaggregater.
K. Tada et al. (1994) skabte en cokulturmodel, hvor endotelceller i en kollagen (type I) gel blev placeret i et indre kammer adskilt fra det ydre kammer, hvori chondrocytter var placeret af et filter med en porestørrelse på 0,4 μm. I en tilstand af fuldstændig isolering fra det ydre kammer dannede humane endotelceller rør i en kollagen gel i nærvær af EGF eller TGF-a. Når begge typer celler blev dyrket samtidigt, blev TGF-a-afhængig rørdannelse af endotelceller hæmmet. Hæmning af denne proces af chondrocytter blev delvist elimineret af anti-TGF-beta-antistoffer. Det kan antages, at TGF-beta produceret af chondrocytter hæmmer vaskulariseringen af selve brusken.
S. Groot et al. (1994) dyrkede samtidigt chondrocytter fra de hypertrofiske og proliferative zoner af knoglevævet fra et 16 dage gammelt musefoster med stykker af hjernevæv. Efter 4 dages dyrkning blev transdifferentiering af chondrocytter til osteoblaster og begyndelsen på osteoiddannelse observeret. Efter 11 dages dyrkning var en del af brusken erstattet af knoglevæv, og knoglematrixen var delvist forkalket. Nogle neuropeptider og neurotransmittere produceret af hjernevæv påvirker osteoblasternes metabolisme eller har receptorer for dem. Blandt dem er noradrenalin, vasoaktivt intestinalt peptid, calcitonin-genrelateret peptid, substans P og somatostatin. Stykker af hjernevæv dyrket sammen med chondrocytter kan producere nogle af de anførte faktorer, der er i stand til at inducere processen med transdifferentiering af chondrocytter til osteoblaster.
 [ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
[ 28 ], [ 29 ], [ 30 ], [ 31 ], [ 32 ], [ 33 ]
Indflydelsen af eksterne faktorer på chondrocytkultur
Indflydelsen af iltspænding på kondrocytmetabolisme
I de fleste tilfælde udvikles kondrocytkulturer under forhold med atmosfærisk ilttryk. Det er imidlertid velkendt, at in vivo-kondrocytter eksisterer under hypoksiske forhold, og ilttryk varierer under forskellige patologiske forhold. Under modningsprocessen observeres betydelige ændringer i blodforsyningen til epifyserne. Da vaskulariseringen varierer i forskellige zoner af vækstpladen, varierer ilttryk i dem også. C. Brighton og R. Heppenstall (1971) demonstrerede, at ilttryk i den hypertrofiske zone i kaninernes skinnebensplade er lavere end i den omgivende brusk. Målinger af nogle metaboliske parametre viste, at kondrocytter er i stand til hurtigt at reagere på lokale ændringer i iltkoncentrationen. Først og fremmest falder kondrocytternes forbrug ved lavt ilttryk. Med et fald i ilttryk fra 21 til 0,04% øges glukoseudnyttelsen, aktiviteten af glykolytiske enzymer og syntesen af mælkesyre øges. Selv ved lavt ilttryk forbliver den absolutte mængde ATP, ADP og AMP stabil. Disse data indikerer, at kondrocytmetabolismen er rettet mod maksimal energibevarelse. Imidlertid ændrer syntetisk aktivitet, og dermed reparationsprocesser, sig under hypoxiske forhold.
Højt ilttryk påvirker også kondrocytmetabolismen, hvilket forårsager et fald i proteoglykan- og DNA-syntese og nedbrydning af bruskmatrixen. Disse effekter er normalt ledsaget af produktionen af frie iltradikaler.
Indflydelsen af ionkoncentration og osmotisk tryk i miljøet på kondrocytfunktion
I nativ brusk adskiller koncentrationen af ioner sig markant fra den i andre væv: natriumindholdet i det ekstracellulære medium er 250-350 mmol, og dets osmolaritet er 350-450 mosmol. Når chondrocytter isoleres fra ECM og inkuberes i standardmedier (DMEM (Dulbeccos Minimal Essential Medium), osmolariteten er 250-280,7 mosmol), ændrer miljøet omkring cellerne sig dramatisk. Derudover er koncentrationen af calcium og kalium i standardmedier betydeligt lavere end i nativt væv, og koncentrationen af anioner er betydeligt højere.
Tilsætning af sukrose til mediet øger dets osmolaritet og inducerer en forbigående intracellulær stigning i koncentrationen af H + og calciumanioner i cytosolen. Sådanne intracellulære ændringer kan påvirke processerne for chondrocytdifferentiering og deres metaboliske aktivitet. J. Urban et al. (1993) fandt, at inkorporeringen af 35'8 -sulfat og 3'H -prolin af isolerede chondrocytter inkuberet i standard DMEM i 2-4 timer kun var 10% af den i nativt væv. Synteseintensiteten nåede et maksimum ved en osmolaritet af det ekstracellulære medium på 350-400 mosmol både i frisk isolerede chondrocytter og i bruskvævseksplanter. Desuden steg volumenet af chondrocytter med 30-40% efter placering af de isolerede celler i standard DMEM med den specificerede osmolaritet. Når chondrocytter dyrkes under forhold med ikke-fysiologisk osmolaritet i 12-16 timer, tilpasser cellerne sig imidlertid de nye forhold, hvilket reducerer intensiteten af biosyntesen i forhold til ændringen i osmolaritet i det ekstracellulære miljø.
P. Borgetti et al. (1995) undersøgte effekten af osmolaritet i ekstracellulært medium på vækst, morfologi og biosyntese af svinechondrocytter. Forfatterne påviste lignende biokemiske og morfologiske træk hos chondrocytter dyrket i medier med osmolaritet på 0,28 og 0,38 mosmol. Ved en medium osmolaritet på 0,48 mosmol blev der observeret et fald i celleproliferation og proteinsyntese i løbet af de første 4-6 timer af dyrkningen, men disse parametre blev efterfølgende genoprettet og nåede til sidst kontrolværdier. Når chondrocytter blev dyrket i et medium med en osmolaritet på 0,58 mosmol, mistede cellerne evnen til at opretholde den fysiologiske intensitet af proliferative processer, og efter 6 dage var antallet af chondrocytter signifikant reduceret. Ved en medium osmolaritet på 0,58 mosmol blev der observeret en dyb hæmning af proteinsyntese. Derudover bevarer chondrocytter deres fysiologiske fænotype, når de dyrkes i medier med en osmolaritet på 0,28-0,38 mOsm; ved højere osmolaritet (0,48-0,58 mOsm) forekommer der betydelige ændringer i cellemorfologien, hvilket manifesterer sig ved tab af den karakteristiske fænotype, transformation af chondrocytter til fibroblastlignende celler og tab af cellernes evne til at danne matrixproteoglykaner. Resultaterne af denne undersøgelse indikerer chondrocytternes evne til at reagere på begrænsede udsving i osmolariteten i det ekstracellulære miljø.
Ændringer i koncentrationen af andre ioner kan også påvirke biosynteseprocesserne i chondrocytter. Således øges graden af 35S (sulfat) inkorporering med halvdelen med en stigning i koncentrationen af kaliumioner fra 5 mmol (koncentrationen i standard DM EM-medium) til 10 mmol (koncentrationen i ECM in vivo). Calciumkoncentrationer under 0,5 mmol fremmede kollagenproduktionen af modne bovine chondrocytter, mens en koncentration på 1-2 mmol (svarende til koncentrationen i standard DM EM-medium) forårsagede et signifikant fald i kollagensyntesen. En moderat stigning i biosyntesen blev observeret ved høje calciumniveauer (2-10 mmol). Forskellige kationer deltager i chondrocytters binding til ECM-proteiner. Således sikrer magnesium- og manganioner binding til fibronektin og type II-kollagen, mens calciumioner ikke deltager i chondrocytters binding til proteiner. Resultaterne af de beskrevne undersøgelser indikerer således indflydelsen af ændringer i ekstracellulære ioner af kalium, natrium, calcium og osmolaritet i mediet på den biosyntetiske funktion af chondrocytter inkuberet i standardmedier.
Effekt af mekanisk stress på kondrocytmetabolisme
Ledimmobilisering forårsager reversibel bruskatrofi, hvilket indikerer behovet for mekaniske stimuli til normale metaboliske processer i ECM. I de fleste tilfælde eksisterer de anvendte cellekulturmodeller under normalt atmosfærisk tryk. M. Wright et al. (1996) viste, at det mekaniske miljø påvirker kondrocytmetabolismen, og celleresponset afhænger af intensiteten og hyppigheden af kompressionsbelastning. Eksperimenter med belastning på eksplantater af intakt ledbrusk in vitro viste et fald i syntesen af proteiner og proteoglykaner under påvirkning af statisk belastning, mens dynamisk belastning stimulerer disse processer. De nøjagtige mekanismer for effekten af mekanisk belastning på brusk er komplekse og er sandsynligvis forbundet med celledeformation, hydrostatisk tryk, osmotisk tryk, elektrisk potentiale og overfladecellulære receptorer for matrixmolekyler. For at studere effekten af hver af disse parametre er det nødvendigt at skabe et system, hvor én parameter kan varieres uafhængigt. For eksempel er eksplantatkultur ikke egnet til at studere celledeformation, men den kan bruges til at studere den generelle effekt af tryk på kondrocytters metaboliske aktivitet. Kompression af brusk fører til celledeformation og ledsages også af fremkomsten af en hydrostatisk trykgradient, elektrisk potentiale, væskestrømning og ændringer i fysisk-kemiske parametre som vandindholdet i matrixen, elektrisk ladningstæthed og osmotisk trykniveau. Celledeformation kan studeres ved hjælp af isolerede chondrocytter nedsænket i agarose- eller kollagengel.
Adskillige systemer er blevet udviklet til at studere effekten af mekanisk stimulering på kondrocytkultur. Nogle forskere bruger systemer, hvor tryk påføres cellekulturen gennem gasfasen. Således observerede JP Veldhuijzen et al. (1979) ved at bruge et tryk på 13 kPa over atmosfærisk tryk med en lav frekvens (0,3 Hz) i 15 minutter en stigning i syntesen af cAMP og proteoglykaner og et fald i DNA-syntese. R. Smith et al. (1996) viste, at intermitterende eksponering af en kultur af primære bovine kondrocytter for hydrostatisk tryk (10 MPa) med en frekvens på 1 Hz i 4 timer forårsagede en stigning i syntesen af aggrecan og type II-kollagen, hvorimod konstant tryk ikke påvirkede disse processer. Ved at bruge et lignende system rapporterede Wright et al. (1996), at cyklisk tryk på cellekultur er forbundet med hyperpolarisering af kondrocytcellemembranen og aktivering af Ca2 + -afhængige kaliumkanaler. Således medieres virkningerne af cyklisk tryk af strækaktiverede ionkanaler i kondrocytmembranen. Kondrocytternes respons på hydrostatisk tryk afhænger af cellekulturbetingelserne og hyppigheden af den påførte belastning. Således reducerer cyklisk hydrostatisk tryk (5 MPa) sulfatindlejringen i kondrocytmonolaget ved en frekvens på 0,05, 0,25 og 0,5 Hz, hvorimod sulfatindlejringen i bruskeksplantatet øges ved en frekvens større end 0,5 Hz.
M. Bushmann et al. (1992) rapporterede, at chondrocytter i agarosegeler ændrer biosyntesen som reaktion på statisk og dynamisk mekanisk belastning på samme måde som det dyrkede intakte organ. Forfatterne fandt, at mekanisk belastning genererer en hyperosmotisk stimulus med et efterfølgende fald i pH i chondrocytter.
Effekten af mekanisk strækning kan studeres på en cellekultur nedsænket i en gel. Strækningskraften kan skabes ved hjælp af et computerstyret vakuum. Når systemet er under en vis grad af vakuum, forlænges bunden af petriskålen med cellekulturen med en kendt mængde, deformationen er maksimal ved kanterne af skålens bund og minimal i midten. Strækningen overføres også til de chondrocytter, der dyrkes i petriskålen. Ved hjælp af denne metode viste K. Holm-vall et al. (1995), at i chondrosarkomceller dyrket i en kollagen (type II) gel øges ekspressionen af mRNA af et 2β-integrin . Et 2β-integrin er i stand til at binde til type II-kollagen. Det betragtes som en mekanoreceptor, da det interagerer med aktinbindende proteiner og dermed forbinder ECM og cytoskelettet.
Effekten af pH på kondrocytmetabolisme
PH-værdien i den interstitielle væske i bruskvævets ECM er mere sur end i andre væv. A. Maroudas (1980) bestemte pH-værdien i ledbruskmatrixen til 6,9. B. Diamant et al. (1966) fandt en pH-værdi på 5,5 under patologiske forhold. Det er kendt, at chondrocytter lever ved lav PO2, hvilket indikerer glykolysens vigtige rolle (95 % af al glukosemetabolisme) i disse cellers metabolisme; glykolysen ledsages af produktionen af en stor mængde mælkesyre.
Ud over forsuring af miljøet med glykolyseprodukter er matrixkomponenterne i sig selv af stor betydning. Den store mængde fast negativ ladning på proteoglykaner ændrer den ekstracellulære ionsammensætning: en høj koncentration af frie kationer (f.eks. H +, Na +, K + ) og en lav koncentration af anioner (f.eks. O2, HCO3) observeres. Derudover udstødes vand fra ECM under påvirkning af mekanisk belastning, hvilket fører til en stigning i koncentrationen af faste negative ladninger og tiltrækning af flere kationer ind i matrixen. Dette ledsages af et fald i pH-værdien i det ekstracellulære miljø, hvilket påvirker den intracellulære pH og derved ændrer chondrocytternes metabolisme. R. Wilkin og A. Hall (1995) undersøgte effekten af pH-værdien i det ekstracellulære og intracellulære miljø på biosyntesen af matrixen af isolerede bovine chondrocytter. De observerede en dobbelt modifikation af matrixsyntesen med et fald i pH. Et lille fald i pH (7,4
 [ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
[ 34 ], [ 35 ], [ 36 ], [ 37 ], [ 38 ], [ 39 ], [ 40 ]
Indflydelsen af kulturmediets sammensætning på chondrocytters metabolisme
Mediet til dyrkning af chondrocytter skal svare til de eksperimentelle betingelser. I de senere år er kalveserum blevet brugt til at optimere dyrkningsbetingelserne. Ved brug af serum skal der dog tages hensyn til en række vigtige punkter:
- udadgående vækst af celler fra periferien af væv i organkulturer,
- variation i sammensætningen af sera fra forskellige serier,
- tilstedeværelsen af ukendte komponenter i dem,
- øget risiko for interferens og artefakter, når man studerer indflydelsen af forskellige biologiske faktorer på cellers metaboliske aktivitet.
Et eksempel på sidstnævnte er en undersøgelse af effekten af EGF på bruskkondrocytter hos rotter. EGF stimulerede inkorporeringen af 3H -thymidin og en stigning i DNA-indholdet i kulturen. Denne effekt var mere udtalt ved lave serumkoncentrationer (<1%), men ved høje koncentrationer (>7,5%) forsvandt effekten.
Det er velkendt, at syntese- og nedbrydningsniveauerne i DMEM suppleret med kalveserum er signifikant forhøjede sammenlignet med in vivo-forhold. Forskelle mellem in vivo- og in vitro-metabolisme kan skyldes forskelle mellem synovialvæsken og det medium, hvori cellerne dyrkes. Lee et al. (1997) dyrkede unge bovine kondrocytter i agarose ved hjælp af et næringsmedium indeholdende DMEM suppleret med 20% kalveserum og en stor mængde normal allogen synovialvæske. Tilstedeværelsen af synovialvæske i mediet inducerede en stigning i mængden af proteoglykaner, op til 80% af den samlede mængde synovialvæske. Disse resultater indikerer, at synovialvæske i kultur inducerer et metabolismeniveau svarende til in vivo, med et højt niveau af glycosaminoglykansyntese og et lavt niveau af celledeling.
G. Verbruggen et al. (1995) viste, at syntesen af 35S -arrpeKaHa af humane chondrocytter dyrket i agarose i serumfri DMEM var 20-30% af det synteseniveau, der observeredes i DMEM suppleret med 10% kalveserum. Forfatterne bestemte, i hvilken grad IGF-1, IGF-2, TGF-R eller insulin genoprettede aggrecanproduktionen i serumfrit medium. Forfatterne konkluderede, at 100 ng/ml insulin, IGF-1 eller IGF-2 delvist genoprettede aggrecansyntesen til 39-53% af kontrolniveauet. Der blev ikke observeret synergisme eller kumulering med en kombination af de anførte faktorer. Samtidig stimulerede 10 ng/ml TGF-R i nærvær af 100 ng/ml insulin aggrecansyntesen til 90% eller mere af referenceniveauet. Endelig påvirkede human serumtransferrin, alene eller i kombination med insulin, ikke aggrecansyntesen. Da kalveserum blev erstattet med bovint serumalbumin, faldt indholdet af aggrecanaggregater betydeligt. Berigelse af dyrkningsmediet med insulin, IGF eller TGF-R genoprettede delvist cellernes evne til at producere aggrecanaggregater. Desuden er IGF-1 og insulin i stand til at opretholde homeostase i cellekulturer. Efter 40 dages dyrkning i et medium beriget med 10-20 ng/ml IGF-1 blev proteoglykansyntesen opretholdt på samme niveau eller endda højere sammenlignet med mediet indeholdende 20% kalveserum. Kataboliske processer forløb langsommere i mediet beriget med IGF-1 end i mediet beriget med 0,1% albuminopløsning, men noget hurtigere i mediet beriget med 20% serum. I langlivede kulturer opretholder 20 ng/ml IGF-1 en stabil celletilstand.
D. Lee et al. (1993) sammenlignede effekten af kulturmediets sammensætning (DMEM, DMEM+20% kalveserum, DMEM+20 ng/ml IGF-1) på DNA-syntese i en bruskvævseksplantagekultur, en monolagskultur og i agarosesuspension. Ved dyrkning i agarose i nærvær af serum observerede forfatterne en tendens til, at chondrocytter grupperede sig i store klynger. Celler dyrket uden serum eller med IGF-1 beholdt en rund form i agarose, samlet i små grupper, men dannede ikke store aggregater. I et monolag var DNA-syntesen signifikant højere i det serumholdige medium end i mediet beriget med IGF-1; DNA-syntesen i sidstnævnte var signifikant højere end i det ikke-berigede medium. Der blev ikke fundet nogen forskelle i DNA-syntese, når chondrocytter blev dyrket i agarosesuspension i et ikke-beriget medium og i et medium med IGF-1. Samtidig blev dyrkning af chondrocytsuspensioner i agarose i et serumberiget medium ledsaget af øget inkorporering af radionukleotidet 3H -thymidin sammenlignet med andre medier.
C-vitamin er nødvendigt for aktivering af enzymer involveret i dannelsen af en stabil spiralformet struktur af kollagenfibriller. Kondrocytter med mangel på ascorbinsyre syntetiserer underhydroxylerede ikke-spiralformede kollagenforløbere, som udskilles langsomt. Administration af ascorbinsyre (50 μg/ml) forårsager hydroxylering af kollagen type II og IX og deres udskillelse i normale mængder. Tilsætning af C-vitamin påvirkede ikke niveauet af proteoglykansyntese. Derfor reguleres kollagensekretion uafhængigt af proteoglykansekretion.

