Nye publikationer
Nyt apparat forbedrer generering af stamceller til Alzheimers-behandling
Sidst revideret: 02.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.

Forskere i Sverige siger, at de har perfektioneret en teknik til at omdanne almindelige hudceller til neurale stamceller, hvilket de siger bringer dem tættere på overkommelige personlige celleterapier til Alzheimers og Parkinsonssygdom.
Ved hjælp af en specialdesignet mikrofluidisk enhed har forskerholdet udviklet en hidtil uset og accelereret tilgang til at omprogrammere menneskelige hudceller til inducerede pluripotente stamceller (iPSC'er) og derefter omdanne dem til neurale stamceller.
Undersøgelsens førsteforfatter, Saumya Jain, siger, at platformen kan forbedre og reducere omkostningerne ved celleterapi ved at gøre cellerne mere kompatible og accepterede af patientens krop. Undersøgelsen blev offentliggjort i tidsskriftet Advanced Science af forskere fra KTH Royal Institute of Technology.
Anna Herland, ledende forfatter af undersøgelsen, sagde, at undersøgelsen demonstrerede den første brug af mikrofluidik til at dirigere iPSC'er til at blive neurale stamceller.
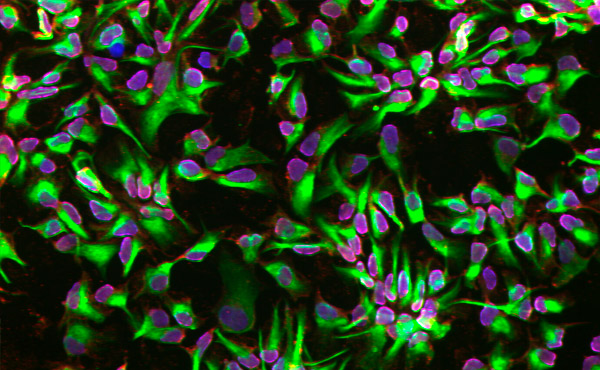
Neurale stamceller differentieret ved hjælp af en mikrofluidisk platform. Foto: KTH Royal Institute of Technology
Transformationen af normale celler til neurale stamceller er faktisk en proces i to trin. Først udsættes cellerne for biokemiske signaler, der får dem til at blive pluripotente stamceller (iPSC'er), som kan generere forskellige typer celler.
De overføres derefter til en kultur, der efterligner de signaler og udviklingsprocesser, der er involveret i dannelsen af nervesystemet. Dette trin, kaldet neural differentiering, omdirigerer cellerne mod at blive neurale stamceller.
I løbet af det seneste årti er laboratoriemiljøet til denne type arbejde gradvist skiftet fra traditionelle tablets til mikrofluidiske enheder. Herland siger, at den nye platform repræsenterer en forbedring inden for mikrofluidik for begge trin: iPSC-generering og neural stamcelledifferentiering.
Ved hjælp af celler fra humane hudbiopsier fandt forskerne, at den mikrofluidiske platform accelererede cellernes engagement i en neural skæbne på et tidligere tidspunkt sammenlignet med dem, der differentieredes i konventionelle plader.
"Vi har dokumenteret, at det begrænsede miljø på den mikrofluidiske platform øger engagementet i at generere neurale stamceller," siger Herland.
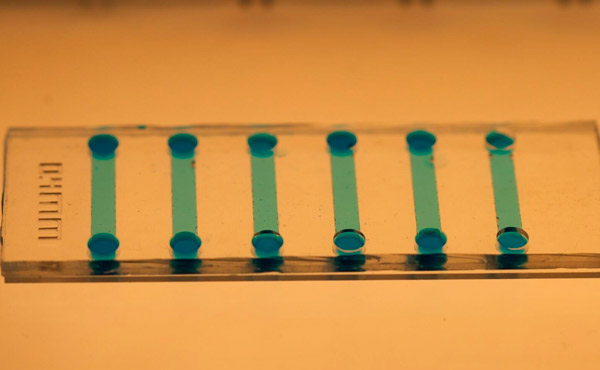
Et nærbillede af den mikrofluidiske chip, der bruges til at inducere stamceller. Foto: KTH Royal Institute of Technology
Jain siger, at den mikrofluidiske chip er nem at fremstille ved hjælp af polydimethylsiloxan (PDMS), og dens mikroskopiske størrelse giver mulighed for betydelige besparelser på reagenser og cellemateriale.
Platformen kan nemt modificeres til at imødekomme differentiering til andre celletyper, tilføjer han. Den kan automatiseres, hvilket giver et lukket system, der sikrer konsistens og pålidelighed i produktionen af meget homogene cellepopulationer.
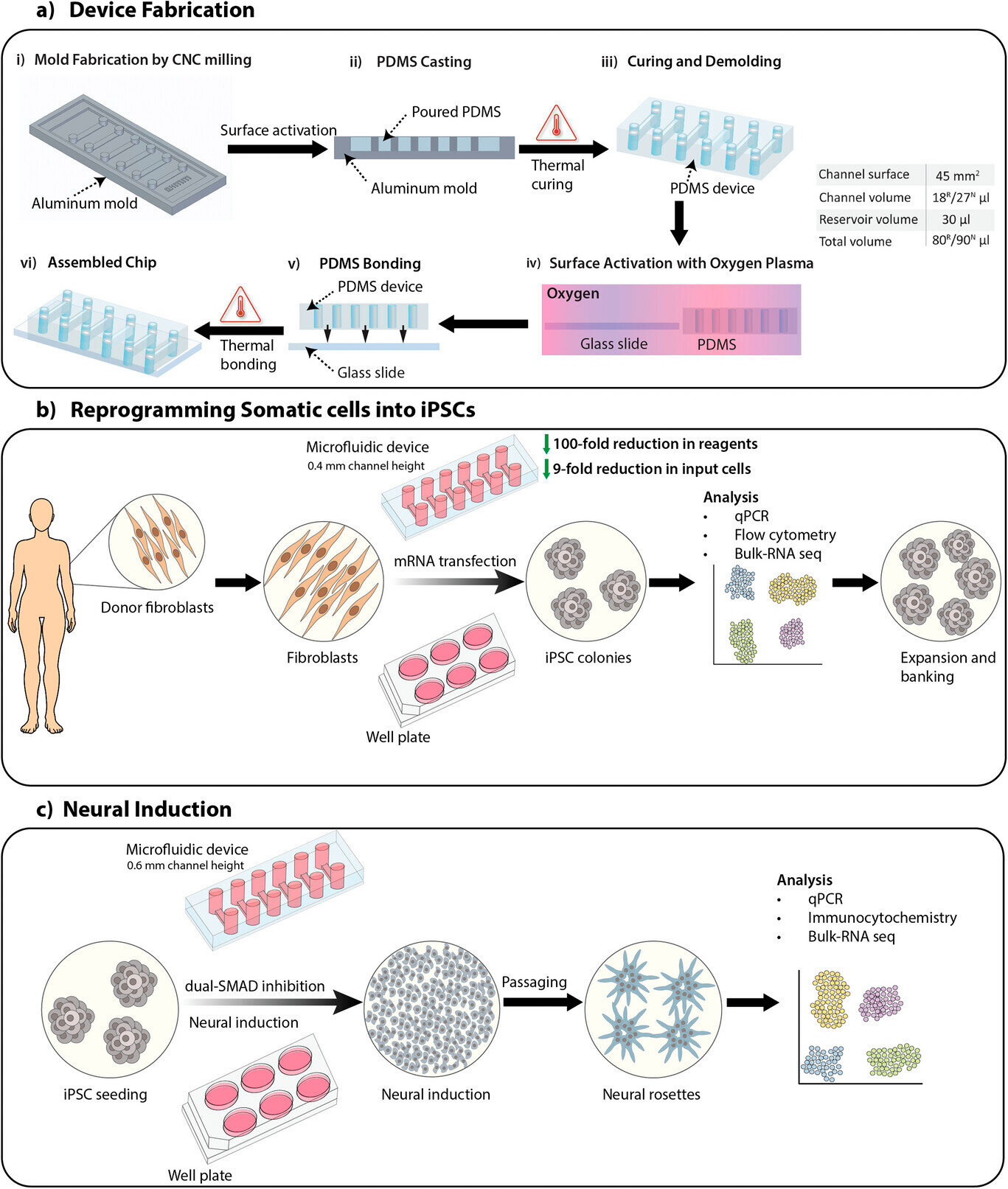
Oversigt over studiet, inklusive fremstilling af enheden, omprogrammering af somatiske celler til inducerede pluripotente stamceller (iPSC'er) og neural induktion af iPSC'er ved hjælp af SMAD dobbeltinhibitionsprotokollen til generering af neurale stamceller.
A) Fremstillingsproces for en mikrofluidisk enhed med 0,4 mm og 0,6 mm høje kanaler til henholdsvis omprogrammering af somatiske celler (R) og neural induktion (N). Kanalvolumener og samlet volumen er angivet i tabellen.
B) Oversigt over omprogrammeringsprocessen af somatiske celler til iPSC'er på mikrofluidiske enheder og plader ved hjælp af mRNA-transfektion.
C) Oversigt over den neurale induktionsproces af iPSC'er i neurale stamceller på mikrofluidiske enheder og plader ved hjælp af SMAD dobbeltinhibitionsprotokollen.
Kilde: Advanced Science (2024). DOI: 10.1002/advs.202401859
"Dette er et skridt i retning af at gøre personlige celleterapier til Alzheimers og Parkinsons sygdomme tilgængelige," tilføjer Jain.
Undersøgelsen involverede også forskere fra Karolinska Institutet og Lunds Universitet, der samarbejdede i IndiCell-konsortiet.
