Nye publikationer
Forskere opdager ny immunosuppressiv mekanisme i hjernekræft
Sidst revideret: 02.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Lektor Filippo Veglia, ph.d., og hans team på Wistar Institute har opdaget en nøglemekanisme, hvorved glioblastom – en alvorlig og ofte dødelig hjernekræft – undertrykker immunsystemet, så tumoren kan vokse uforstyrret af kroppens forsvar.
Deres opdagelse blev offentliggjort i artiklen "Glukosedrevet histonlaktylering promotes the immunosuppressive activity of monocyte-derived macrophages in glioblastom" i tidsskriftet Immunity.
"Vores undersøgelse viser, at kræfts selvforstærkende mekanismer, hvis de er tilstrækkeligt forstået, kan udnyttes meget effektivt mod sygdommen," sagde Dr. Veglia.
"Jeg ser frem til fremtidige studier af metabolismemedierede immunsuppressionsmekanismer i glioblastom og håber, at vi vil fortsætte med at lære mere om, hvordan vi bedre kan forstå og bekæmpe denne kræftform."
Indtil nu er der kun lidt undersøgt, hvordan monocyt-afledte makrofager og mikroglia skaber et immunsuppressivt tumormikromiljø i glioblastom.
Veglia-laboratoriet undersøgte de cellulære mekanismer bag immunsuppression i glioblastom og fandt, at efterhånden som glioblastom progredierer, begynder monocyt-afledte makrofager at overstige mikroglia, hvilket tyder på, at dominansen af monocyt-afledte makrofager i tumormikromiljøet er gavnlig for kræft med hensyn til immununddragelse.
Monocyt-afledte makrofager, men ikke mikroglia, blokerede faktisk aktiviteten af T-celler (immunceller, der dræber tumorceller) i prækliniske modeller og hos patienter. Holdet bekræftede dette ved at evaluere prækliniske glioblastommodeller med kunstigt reduceret antal monocyt-afledte makrofager.
Som forventet viste modeller med færre maligne makrofager i tumormikromiljøet forbedrede resultater sammenlignet med standard glioblastommodeller.
Glioblastom tegner sig for lidt over halvdelen af alle ondartede tumorer, der opstår i hjernen, og prognosen for patienter, der diagnosticeres med sygdommen, er ekstremt dårlig: kun 25% af patienterne overlever det første år efter diagnosen. Glioblastom er farligt ikke kun på grund af dets placering i hjernen, men også på grund af det immunsuppressive tumormikromiljø, hvilket gør glioblastom resistent over for lovende immunterapier.
Ved at programmere visse immunceller, såsom makrofager (monocyt-afledte makrofager og mikroglia), til at arbejde for tumoren snarere end imod den, skaber glioblastom et tumormikromiljø for sig selv, der tillader kræften at vokse aggressivt, samtidig med at den undgår anti-kræft immunresponser.
Afklaring af mekanismen
Efter at have bekræftet rollen af monocyt-afledte makrofager, forsøgte Weglias laboratorium derefter at forstå præcis, hvordan disse kræftassocierede immunceller virker mod immunsystemet.
De sekventerede makrofagerne for at bestemme, om cellerne havde unormale genekspressionsmønstre, der kunne indikere gener, der spiller en rolle i immundæmpning, og de undersøgte også makrofagernes metaboliske mønstre for at se, om den unormale genekspression var relateret til metabolisme.
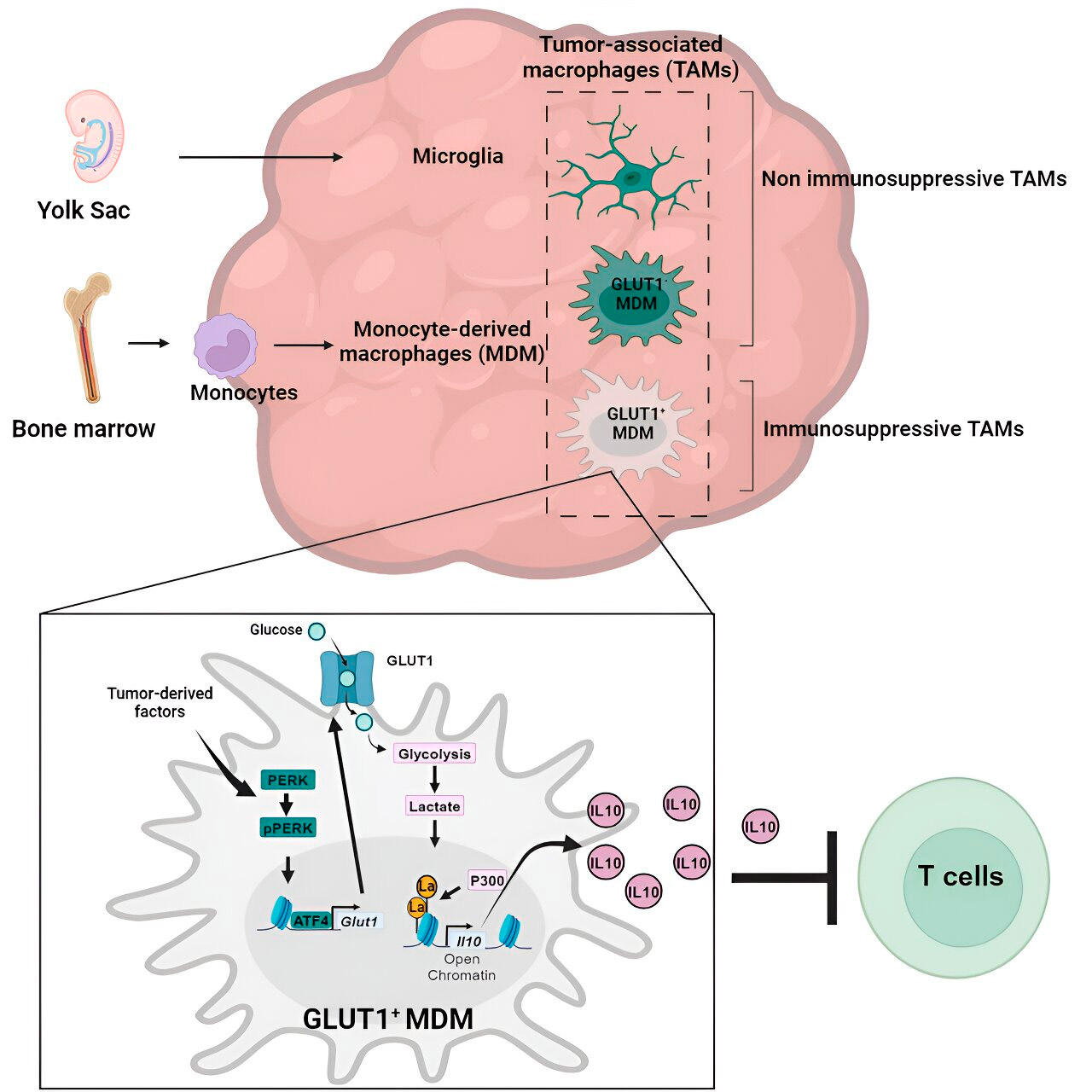
Gen- og metabolisk analyse førte dem til glukosemetabolisme. En række tests viste, at monocyt-afledte makrofager med øget glukosemetabolisme og ekspression af GLUT1, den primære transportør for glukose, blokerede T-cellefunktionen ved at frigive interleukin-10 (IL-10).
Holdet viste, at glioblastom forstyrrer glukosemetabolismen i disse makrofager, hvilket forårsager deres immunsuppressive aktivitet.
Histonlaktylering og dens rolle
Forskerne fandt ud af, at nøglen til den glukosemetabolisme-relaterede immunsuppressive aktivitet af monocyt-afledte makrofager ligger i en proces kaldet "histon-laktylering." Histoner er strukturelle proteiner i genomet, der spiller en nøglerolle i ekspressionen af gener som IL-10 i visse sammenhænge.
Ved hurtigt at metabolisere glukose producerer monocyt-afledte makrofager laktat, et biprodukt af glukosemetabolismen. Histoner kan blive "laktylerede" (dvs. laktat integreres i histonerne) på en sådan måde, at histonorganisationen fremmer ekspressionen af IL-10, som produceres af monocyt-afledte makrofager for at understøtte kræftcellevækst.
Løsning på problemet
Men hvordan kan den immunsuppressive aktivitet af monocyt-afledte makrofager, der er forbundet med glukosemetabolisme, stoppes? Dr. Veglia og hans team identificerede en mulig løsning: PERK, et enzym, de identificerede som en regulator af glukosemetabolisme og GLUT1-ekspression i makrofager.
I prækliniske modeller af glioblastom forringede målretning af PERK histon-laktylering og makrofag-immunsuppressiv aktivitet, og når det kombineres med immunterapi, blokerede det glioblastomprogression og inducerede langvarig immunitet, der beskyttede hjernen mod tumorgenvækst. Dette tyder på, at målretning af PERK-histon-laktyleringsaksen kan være en levedygtig strategi til at bekæmpe denne dødelige hjernekræft.
