Nye publikationer
ARID1A-genmutation gør tumorer følsomme over for immunterapi
Sidst revideret: 02.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Immunterapi har revolutioneret kræftbehandlingen i de senere år. I stedet for at målrette tumorer direkte, dirigerer immunterapi patienternes immunsystem til at angribe tumorer mere effektivt. Dette er især effektivt for nogle sværtbehandlelige kræftformer. Imidlertid reagerer mindre end halvdelen af alle kræftpatienter på nuværende immunterapier, hvilket skaber et presserende behov for at identificere biomarkører, der kan forudsige, hvilke patienter der mest sandsynligt vil have gavn af behandlingen.
For nylig har forskere bemærket, at patienter, hvis tumorer har en mutation i ARID1A-genet, er mere tilbøjelige til at reagere positivt på immunkontrolpunktsblokade, en type immunterapi, der virker ved at holde kræftbekæmpende immunceller aktiverede.
Fordi ARID1A-genmutationen er til stede i mange kræftformer, herunder endometrie-, æggestokk-, kolorektal-, mave-, lever- og bugspytkirtelkræft, spekulerede forskere fra Salk Institute på, hvordan det kunne bidrage til behandlingsfølsomhed, og hvordan klinikere kunne bruge disse oplysninger til at personliggøre kræftbehandlingen for hver patient.
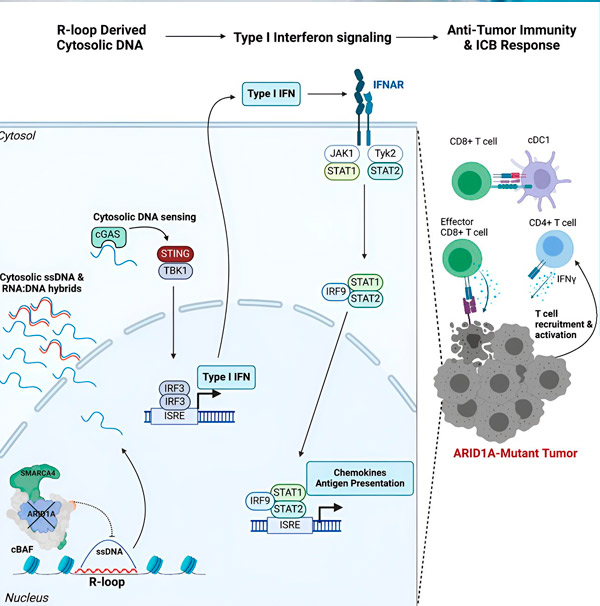
Deres nye undersøgelse, offentliggjort i tidsskriftet Cell, viser, at ARID1A-mutationen gør tumorer følsomme over for immunterapi ved at rekruttere kræftbekæmpende immunceller til tumoren gennem et antivirallignende immunrespons.
Forskerne foreslår, at denne mutation og det antivirale immunrespons kan bruges som en biomarkør til bedre at udvælge patienter til specifikke immunterapier, såsom immunkontrolpunktblokade. Disse resultater tilskynder også til udvikling af lægemidler, der er målrettet mod ARID1A og relaterede proteiner for at gøre andre tumorer mere følsomme over for immunterapi.
"Dette kunne virkelig ændre resultatet af kræftbehandling for patienter," sagde lektor Diana Hargreaves, ledende forfatter af studiet. "Patienter med ARID1A-mutationen har allerede et immunrespons, så alt, hvad vi skal gøre, er at forstærke dette respons med immunkontrolpunktblokade for at hjælpe dem med at ødelægge deres tumorer indefra."
Selvom det var kendt, at personer med ARID1A-mutationer reagerede godt på immunkontrolpunktsblokade, forblev den præcise sammenhæng mellem de to uklar. For at kaste lys over mekanismen brugte forskere ved Salk Institute musemodeller af melanom og kolorektal cancer med både ARID1A-mutationen og funktionel ARID1A.
Kilde: Cell (2024). DOI: 10.1016/j.cell.2024.04.025
Holdet observerede et robust immunrespons i alle modeller med ARID1A-mutationen, men ikke i dem, hvor ARID1A var funktionel, hvilket understøtter ideen om, at ARID1A-mutationen faktisk driver denne respons. Men hvordan fungerer dette på molekylært niveau?
"Vi fandt ud af, at ARID1A spiller en vigtig rolle i cellekernen ved at opretholde en korrekt DNA-organisation," siger Matthew Maxwell, førsteforfatter af studiet og kandidatstuderende i Hargreaves-laboratoriet. "Uden funktionel ARID1A kan frit DNA udskæres og frigives i cytosolen, hvilket aktiverer et ønskeligt antiviralt immunrespons, der kan forstærkes ved immunkontrolpunktblokade."
ARID1A-genet koder for et protein, der hjælper med at regulere formen på vores DNA og opretholde genomstabilitet. Når ARID1A muterer, sætter det i gang en Rube-Goldberg-lignende kædereaktion i kræftceller.
For det første resulterer manglen på funktionelt ARID1A i, at DNA frigives til cytosolen. Det cytosoliske DNA aktiverer derefter et antiviralt alarmsystem, cGAS-STING-signalvejen, fordi vores celler er tilpasset til at markere ethvert DNA i cytosolen som fremmed for at beskytte mod virusinfektioner. I sidste ende engagerer cGAS-STING-signalvejen immunsystemet til at rekruttere T-celler til tumoren og aktivere dem til specialiserede kræftdræber-T-celler.
Ved hvert trin, afhængigt af det foregående, fører denne kædereaktion af begivenheder – ARID1A-mutation, DNA-udslip, cGAS-STING-alarm, T-celle-rekruttering – til en stigning i antallet af kræftbekæmpende T-celler i tumoren. Blokering af immunkontrolpunkter kan derefter bruges til at sikre, at disse T-celler forbliver aktiverede, hvilket forbedrer deres evne til at bekæmpe kræft.
"Vores resultater giver en ny molekylær mekanisme, hvorved en ARID1A-mutation kan bidrage til et antitumorimmunrespons," siger Hargreaves. "Det spændende ved disse resultater er deres translationelle potentiale. Vi kan bruge ARID1A-mutationer til at udvælge patienter til immunkontrolpunktblokade, og vi ser nu en mekanisme, hvorved lægemidler, der hæmmer ARID1A eller dets proteinkompleks, kan bruges til yderligere at forbedre immunterapi hos andre patienter."
Ved at beskrive den mekanisme, hvorved immunkontrolpunktblokade er mere effektiv i ARID1A-muterede kræftformer, giver forskerne klinikere en begrundelse for at prioritere denne immunterapi for patienter med en ARID1A-mutation. Disse resultater er et vigtigt skridt i retning af at personliggøre kræftbehandling og inspirerer udviklingen af nye terapier, der er målrettet ARID1A og dets proteinkompleks.
Salk Institute-teamet håber, at deres resultater fremadrettet vil forbedre behandlingsresultaterne for patienter med forskellige typer kræft forbundet med ARID1A-mutationer, og har til hensigt at udforske denne kliniske oversættelse i samarbejde med University of California, San Diego.
