Nye publikationer
System til levering af lægemidler i lukket kredsløb kan forbedre levering af kemoterapi
Sidst revideret: 02.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Når kræftpatienter gennemgår kemoterapi, beregnes doserne af de fleste lægemidler ud fra patientens kropsoverfladeareal. Dette estimeres ved hjælp af en ligning, der tager hensyn til patientens højde og vægt. Denne ligning blev formuleret i 1916 baseret på data fra blot ni patienter.
Denne forenklede doseringsmetode tager ikke højde for andre faktorer og kan resultere i, at en patient får for meget eller for lidt af et lægemiddel. Som følge heraf kan nogle patienter opleve unødvendig toksicitet eller utilstrækkelig effektivitet af den kemoterapi, de modtager.
For at forbedre nøjagtigheden af kemoterapidosering har MIT-ingeniører udviklet en alternativ tilgang, der gør det muligt at tilpasse dosis til hver patient. Deres system måler mængden af lægemiddel i patientens krop og sender disse data til en controller, der kan justere infusionshastigheden i overensstemmelse hermed.
Denne tilgang kan hjælpe med at kompensere for forskelle i lægemidlers farmakokinetik forårsaget af kropssammensætning, genetisk prædisponering, kemoterapi-induceret organtoksicitet, interaktioner med andre lægemidler og fødevarer samt døgnrytmen i de enzymer, der er ansvarlige for at nedbryde kemoterapilægemidler, siger forskerne.
"Ved at anerkende fremskridt i forståelsen af, hvordan lægemidler metaboliseres, og anvende tekniske værktøjer til at forenkle personlig dosering, mener vi, at vi kan bidrage til at transformere sikkerheden og effektiviteten af mange lægemidler," sagde Giovanni Traverso, lektor i maskinteknik ved MIT, gastroenterolog ved Brigham and Women's Hospital og seniorforfatter af undersøgelsen.
Louis DeRidder, en kandidatstuderende ved MIT, er hovedforfatter til artiklen, der er offentliggjort i tidsskriftet Med.
Løbende overvågning
I dette studie fokuserede forskerne på et lægemiddel kaldet 5-fluorouracil, som bruges til behandling af kolorektal cancer og andre kræftformer. Lægemidlet administreres typisk over en 46-timers periode, og doseringen bestemmes ved hjælp af en formel baseret på patientens højde og vægt, hvilket giver et estimat af kroppens overfladeareal.
Denne tilgang tager dog ikke højde for forskelle i kropssammensætning, der kan påvirke, hvordan lægemidlet fordeles i kroppen, eller genetiske variationer, der påvirker, hvordan det metaboliseres. Disse forskelle kan føre til skadelige bivirkninger, hvis der gives for meget af lægemidlet. Hvis der ikke gives nok af lægemidlet, dræber det muligvis ikke tumoren som forventet.
"Mennesker med samme kropsoverfladeareal kan have meget forskellige højder og vægte, forskellig muskelmasse eller forskellig genetik, men så længe højden og vægten, der indgår i den ligning, giver det samme kropsoverfladeareal, er deres dosis identisk," siger DeRidder, ph.d.-kandidat i medicinsk teknik og medicinsk fysik på Harvard-MIT-programmet i sundhedsvidenskab og teknologi.
En anden faktor, der kan ændre mængden af lægemiddel i blodet på et givet tidspunkt, er døgnrytmevariationer i et enzym kaldet dihydropyrimidindehydrogenase (DPD), som nedbryder 5-fluorouracil. Ekspressionen af DPD, ligesom mange andre enzymer i kroppen, reguleres af en døgnrytme. Nedbrydningen af 5-FU af DPD er således ikke konstant, men varierer med tidspunktet på dagen. Disse døgnrytmer kan resultere i en tidobling i mængden af 5-FU i en patients blod under en infusion.
"Ved at bruge kropsoverfladeareal til at beregne kemoterapidosis ved vi, at to personer kan have meget forskellige toksiciteter fra 5-fluorouracil. Én patient kan have behandlingscyklusser med minimal toksicitet og derefter en cyklus med forfærdelig toksicitet. Noget har ændret sig i den måde, patienten metaboliserede kemoterapien på fra en cyklus til den næste. Vores forældede doseringsmetode fanger ikke disse ændringer, og patienterne lider som følge heraf," siger Douglas Rubinson, en klinisk onkolog ved Dana-Farber Cancer Institute og en af forfatterne til artiklen.
En måde at forsøge at kompensere for variation i farmakokinetikken ved kemoterapi er en strategi kaldet terapeutisk lægemiddelmonitorering, hvor patienten afgiver en blodprøve ved afslutningen af en behandlingscyklus. Efter at denne prøve er analyseret for lægemiddelkoncentrationer, kan dosis justeres om nødvendigt ved begyndelsen af den næste cyklus (normalt to uger for 5-fluorouracil).
Denne tilgang har vist sig at føre til bedre resultater for patienter, men har ikke været udbredt anvendt til kemoterapier som 5-fluorouracil.
MIT-forskerne ønskede at udvikle en lignende type overvågning, men på en automatiseret måde, der ville give mulighed for at personliggøre lægemiddeldosering i realtid, hvilket kunne føre til bedre resultater for patienterne.
I deres lukkede system kan lægemiddelkoncentrationer overvåges kontinuerligt, og denne information bruges til automatisk at justere infusionshastigheden af kemoterapimedicinen for at holde dosis inden for målområdet.
Dette lukkede kredsløbssystem gør det muligt at personliggøre lægemiddeldosering for at tage højde for døgnrytmen af lægemiddelmetaboliserende enzymniveauer, samt eventuelle ændringer i patientens farmakokinetik siden den sidste behandling, såsom kemoterapi-induceret organtoksicitet.
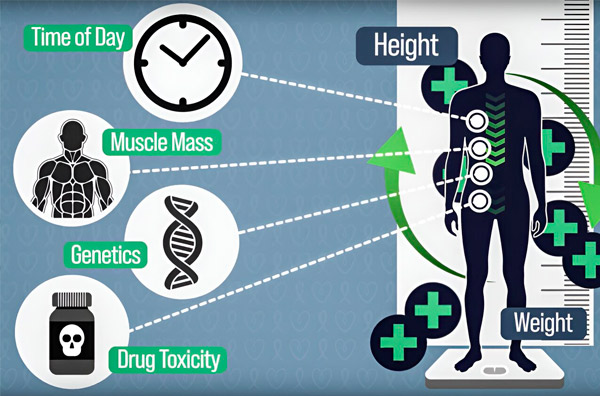
For at gøre kemoterapidosering mere præcis har MIT-ingeniører udviklet en metode til kontinuerligt at måle mængden af lægemiddel i en patients krop under en infusion, der varer flere timer. Dette vil hjælpe med at kompensere for forskelle forårsaget af kropssammensætning, genetik, lægemiddeltoksicitet og døgnrytmevariationer. Kilde: Udlånt af forskerne.
Det nye system, som forskerne har udviklet, kendt som CLAUDIA (Closed-Loop AUtomated Drug Infusion regulator), bruger kommercielt tilgængeligt udstyr til hvert trin. Blodprøver tages hvert femte minut og klargøres hurtigt til analyse. Koncentrationen af 5-fluorouracil i blodet måles og sammenlignes med målområdet.
Forskellen mellem den ønskede og den målte koncentration indtastes i en kontrolalgoritme, som derefter justerer infusionshastigheden efter behov for at holde dosis inden for det koncentrationsområde, hvor lægemidlet er effektivt og ikke-toksisk.
"Vi har udviklet et system, hvor vi kontinuerligt kan måle lægemiddelkoncentrationen og justere infusionshastigheden i overensstemmelse hermed for at opretholde lægemiddelkoncentrationen inden for det terapeutiske vindue," siger DeRidder.
Hurtig justering
I dyreforsøg fandt forskerne ud af, at de ved hjælp af CLAUDIA kunne holde mængden af lægemiddel i blodet i kroppen inden for målområdet omkring 45 procent af tiden.
Lægemiddelniveauerne hos dyr, der fik kemoterapi uden CLAUDIA, forblev kun i gennemsnit inden for målområdet i 13 procent af tilfældene. Forskerne testede ikke effektiviteten af lægemiddelniveauerne i dette studie, men det menes, at opretholdelse af koncentrationer inden for målområdet resulterer i bedre resultater og mindre toksicitet.
CLAUDIA var også i stand til at opretholde 5-fluorouracil-dosen inden for målområdet, selv når der blev administreret et lægemiddel, der hæmmer DPD-enzymet. Hos dyr, der fik denne hæmmer uden kontinuerlig overvågning og justering, steg 5-fluorouracil-niveauerne op til otte gange.
Til denne demonstration udførte forskerne manuelt hvert trin i processen ved hjælp af standardudstyr, men planlægger nu at automatisere hvert trin, så overvågning og dosisjusteringer kan udføres uden menneskelig indgriben.
Til at måle lægemiddelkoncentrationer brugte forskerne højtydende væskekromatografi-massespektrometri (HPLC-MS), en teknik, der kan tilpasses til at detektere næsten alle typer lægemidler.
"Vi ser en fremtid, hvor vi kan bruge CLAUDIA til ethvert lægemiddel, der har de passende farmakokinetiske egenskaber og kan detekteres ved HPLC-MS, hvilket muliggør personlig dosering for mange forskellige lægemidler," siger DeRidder.
