Et mål har vist sig at neutralisere toksiske proteiner i Parkinsons sygdom
Sidst revideret: 14.06.2024

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
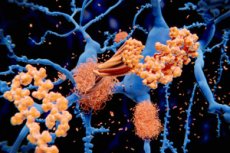
Forskere fra UAB (Autonomous University of Barcelona) har identificeret et sted i tidlige aggregater af alfa-synuclein-proteinet, som kan målrettes for at forhindre det i at blive giftige amyloidfibriller, der ophobes i hjernen hos mennesker, der lider af Parkinsons sygdom
stil>.Opdagelsen blev for nylig offentliggjort i Journal of the American Chemical Society i en undersøgelse, der uddyber forståelsen af de strukturelle egenskaber af disse oprindelige aggregater eller oligomerer, og åbner døren til udviklingen af nye terapeutiske strategier for at inaktivere dem.
Undersøgelsen blev udført af forskerne Salvador Ventura, Jaime Santos, Jordi Pujols og Irantzu Palhares fra Institut for Bioteknologi og Biomedicin (IBB) og Institut for Biokemi og Molekylær Biologi.
Alfa-synuklein-aggregation er et karakteristisk træk ved Parkinsons sygdom og andre synukleinopatier. Dette er en dynamisk proces, hvor proteinet selv samler sig for at danne oligomerer, der til sidst udvikler sig til giftige amyloidfibriller, der ophobes i patientens hjerne.
Alfa-synuclein-oligomerer spiller en nøglerolle i udviklingen og progressionen af sygdommen og er derfor lovende terapeutiske og diagnostiske mål, især i de tidlige stadier af sygdommen. Men deres forbigående og meget dynamiske natur begrænser studiet af deres struktur og gør det vanskeligt at udvikle terapier, der tager sigte på at blokere dem.
I en tidligere undersøgelse fandt forskerne ud af, at et lille molekyle, det bakterielle peptid PSMα3, hæmmer alfa-synuclein-aggregation ved at binde sig til oligomerer, blokere fibrilovergang og hæmme neurotoksicitet. I denne undersøgelse bestemte de, hvor, hvordan og hvornår denne binding forekommer i oligomerer, og identificerede en nøgleregion for den strukturelle omdannelsesproces, der er forbundet med patogenesen af Parkinsons sygdom.
"Vi har identificeret en sekvensstruktur, der er påkrævet for at omdanne oligomerer til fibriller, og derved åbne et nyt felt for udvikling af molekyler rettet mod oligomerer. Ved hjælp af dette område kan vi udvikle nye molekyler, der efterligner egenskaberne af PSMα3 med meget større affinitet og styrke," forklarer Ventura, direktør for Protein Folding and Conformational Diseases Research Group ved IBB og koordinator af undersøgelsen.
Ved at kombinere strukturelle, biofysiske og biokemiske analyser fandt forskerne ud af, at PSMα3 virker ved at binde sig til den ene ende af alfa-synuklein (N-terminus), som regulerer processen med at omdanne oligomerer til fibriller. Når det er bundet, dækker peptidet to små tilstødende områder af proteinet, P1 og P2, som har vist sig at være kritiske for denne patologiske overgang.
"Denne region er et ideelt terapeutisk mål, fordi det kun genkendes af peptider i oligomerer; dette giver os mulighed for at målrette aggregater uden at påvirke den funktionelle monomere form af alfa-synuclein, som er afgørende for normal hjernefunktion," siger Ventura.
p>Undersøgelsen har også betydning for at fremme vores forståelse af de molekylære mekanismer i den arvelige form for Parkinsons sygdom. Denne form, som normalt påvirker mennesker i en yngre alder, er ofte forbundet med mutationer placeret i P2-regionen af alfa-synuclein, såsom G51D-mutationen, som forårsager en af de mest aggressive former for sygdommen.
Forskere har vist, at G51D-mutationen i den identificerede kritiske region forårsager konformationelle fluktuationer, der bremser transformationen af oligomerer til fibriller. Denne afmatning resulterer i akkumulering af giftige, langlivede oligomerer, som ineffektivt behandles af molekylære chaperoner, der forsøger at adskille dem.
"Vores opdagelse kan føre til udviklingen af specifikke peptider, der kan målrette mod disse muterede former for alfa-synuclein, og derfor en personlig tilgang til terapi for dem, der lider af en arvelig form for Parkinsons sygdom. Vi arbejder allerede på at udvikle disse molekyler", siger Ventura.
