Nye publikationer
Protein med ansvar for genetisk inflammatorisk sygdom identificeret
Sidst revideret: 02.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Et forskerhold ledet af Dr. Hirotsugu Oda fra CECAD Cluster of Excellence for Aging Research ved Köln Universitet har opdaget den rolle, som et bestemt proteinkompleks spiller i visse former for immunforstyrrelser. Dette resultat kan føre til udvikling af nye terapeutiske tilgange, der sigter mod at reducere autoinflation og "genoprette" immunsystemet hos patienter, der lider af en genetisk dysfunktion af dette proteinkompleks.
Undersøgelsen "Bialelisk human SHARPIN-tab af funktion inducerer autoinflammation og immundefekt" blev offentliggjort i tidsskriftet Nature Immunology.
Det lineære ubiquitin-assembling-kompleks (LUBAC), der består af proteinerne HOIP, HOIL-1 og SHARPIN, har længe været anerkendt for sin kritiske rolle i at opretholde immunhomeostase. Tidligere undersøgelser af mus har vist de alvorlige konsekvenser af SHARPIN-tab, hvilket fører til alvorlig dermatitis på grund af overdreven hudcelledød. De specifikke sundhedsmæssige konsekvenser af SHARPIN-mangel hos mennesker er dog forblevet uklare.
Forskerholdet rapporterede for første gang to personer med SHARPIN-mangel, der udviser symptomer på autoinflation og immundefekt, men uventet nok ikke viser dermatologiske problemer, som de gjorde hos mus.
Ved yderligere undersøgelse blev det konstateret, at disse individer havde et forringet kanonisk NF-κB-respons, en vigtig immunresponsvej. De havde også øget modtagelighed for celledød induceret af medlemmer af tumornekrosefaktor (TNF)-superfamilien. Behandling af en SHARPIN-defekt patient med anti-TNF-behandling, som specifikt hæmmer TNF-induceret celledød, resulterede i fuldstændig remission af autoinflation på celleniveau og i klinisk præsentation.
Undersøgelsen viser, at overdreven og ukontrolleret celledød spiller en kritisk rolle i genetiske inflammatoriske sygdomme hos mennesker. Odas team tilføjede SHARPIN-mangel som et nyt medlem af en gruppe af genetiske inflammatoriske sygdomme hos mennesker, som de foreslår at kalde "medfødte celledødsfejl".
Beskyttelse mod immunforstyrrelser Undersøgelsen blev igangsat i Dr. Dan Kastners laboratorium ved National Institutes of Health (NIH) i USA. Forskerne dér havde mulighed for at observere en patient med uforklarlige episoder med feber, gigt, colitis og immundefekt, der debuterede i barndommen.
Efter at have indhentet informeret samtykke udførte de exomsekventering på patienten og dennes familiemedlemmer og fandt, at patienten havde en ødelæggende genetisk variant i SHARPIN-genet, der førte til uopdagelige niveauer af SHARPIN-proteinet. De fandt også, at patientens celler viste en øget tilbøjelighed til at dø i både dyrkede celler og i patientens biopsier.
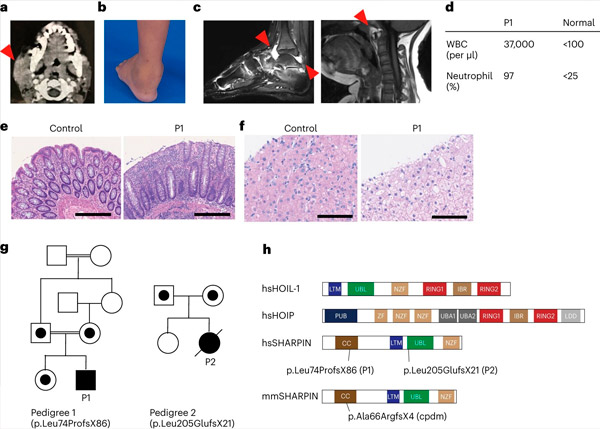
SHARPIN-mangel hos mennesker forårsager autoinflammation og leverglykogenose. Kilde: Nature Immunology (2024). DOI: 10.1038/s41590-024-01817-w
Holdet fandt også, at udviklingen af lymfoide germinale centre – specialiserede mikrostrukturer i polypperne, der er afgørende for modningen af vores immunsystems B-celler og dermed for antistofproduktion – var signifikant reduceret på grund af øget B-celledød. Disse fund forklarer patienternes immundefekt og fremhæver LUBAC's vigtige rolle i at opretholde immunhomeostase hos mennesker.
"Vores undersøgelse fremhæver den kritiske betydning af LUBAC i beskyttelsen mod immunforstyrrelser. Ved at belyse de molekylære mekanismer, der ligger til grund for LUBAC-mangel, baner vi vejen for nye terapeutiske strategier, der sigter mod at genoprette immunhomeostase," sagde Oda, hovedforfatter af undersøgelsen.
Han tilføjede: "En af patienterne med SHARPIN-mangel havde været kørestolsbundet i årevis, før vi så ham første gang. Hans ankler var betændte, og det var for smertefuldt at gå. Den genetiske diagnose gjorde det muligt for os at målrette den korrekte molekylære signalvej, der ligger til grund for hans tilstande."
Siden patienten begyndte at modtage anti-TNF-behandling, har han været symptomfri i næsten syv år. "Som kliniker og forsker er jeg glad for at have muligheden for at påvirke én patients liv positivt gennem vores forskning," konkluderede Oda.
