Nye publikationer
Nye genetiske mekanismer kan være et terapeutisk mål mod gliom
Sidst revideret: 02.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
En undersøgelse foretaget af Shi-Yuan Cheng, ph.d. og professor i Ken og Ruth Daveys afdeling for neuroonkologi på neurologisk afdeling, har identificeret nye mekanismer, der ligger til grund for alternative RNA-splejsningshændelser i gliomtumorceller, og som kan tjene som nye terapeutiske mål. Resultaterne af undersøgelsen er offentliggjort i Journal of Clinical Investigation.
"Vi har fundet en anden måde at behandle gliomer på gennem alternativ splejsning og opdaget nye mål, der ikke tidligere er blevet identificeret, men som er vigtige for gliommalignitet," sagde Xiao Song, MD, PhD, lektor i neurologi og hovedforfatter af undersøgelsen.
Gliomer er den mest almindelige type primær hjernetumor hos voksne og stammer fra gliaceller, som findes i centralnervesystemet og understøtter nærliggende neuroner. Gliomer er meget resistente over for standardbehandlinger, herunder stråling og kemoterapi, på grund af tumorens genetiske og epigenetiske heterogenitet, hvilket understreger behovet for at finde nye terapeutiske mål.
Tidligere forskning fra Cheng-laboratoriet, offentliggjort i tidsskriftet Cancer Research, viste, at den vigtige splejsningsfaktor SRSF3 er signifikant forhøjet i gliomer sammenlignet med normale hjerner, og SRSF3-reguleret RNA-splejsning fremmer gliomvækst og -progression ved at påvirke flere cellulære processer i tumorceller.
RNA-splejsning er en proces, der involverer fjernelse af introner (ikke-kodende regioner af RNA) og sammenføjning af exoner (kodende regioner) for at danne et modent mRNA-molekyle, der understøtter genekspression i en celle.
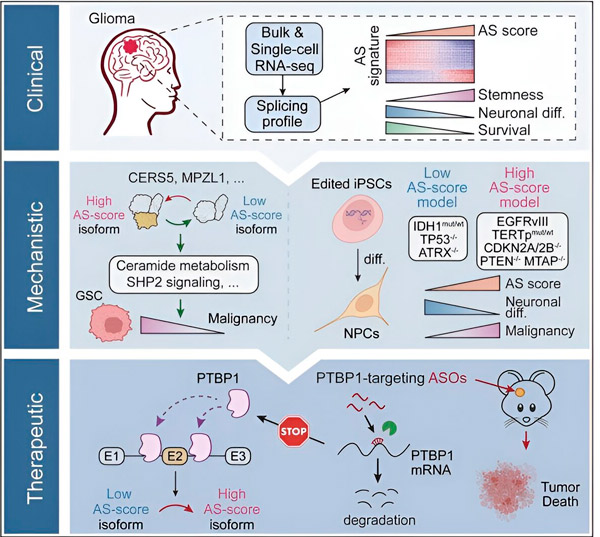
I den foreliggende undersøgelse havde forskerne til formål at identificere ændringer i alternativ splejsning i gliomtumorceller, de mekanismer, der ligger til grund for disse ændringer, og bestemme deres potentiale som terapeutiske mål.
Ved hjælp af beregningsmetoder og RNA-sekventeringsteknologier undersøgte forskerne splejsningsændringer i gliomtumorceller fra patientprøver. For at bekræfte disse ændringer brugte de CRISPR-genredigeringsteknologier til at introducere forskellige gliomdrivermutationer i gliommodeller afledt af humane inducerede pluripotente stamceller (iPSC'er).
De fandt ud af, at disse splejsningsændringer forstærkes af en variant af epidermal vækstfaktorreceptor III (EGFRIII), som vides at være overudtrykt i mange tumorer, herunder gliomer, og hæmmes af en mutation i IDH1-genet.
Forskere har bekræftet funktionen af to RNA-splejsningsbegivenheder, der skaber forskellige proteinisoformer med forskellige aminosyresekvenser.
"Kun én af disse isoformer kan fremme tumorvækst, i modsætning til den anden isoform, som normalt udtrykkes i den normale hjerne. Tumorer udnytter denne mekanisme til selektivt at udtrykke den tumorfremmende isoform frem for den normale hjerneisoform," sagde Song.
Holdet analyserede derefter upstream RNA-bindende proteiner og fandt, at PTBP1-genet regulerer tumorfremmende RNA-splejsning i gliomceller. Ved hjælp af en ortotopisk gliommodel i immundefekte mus målrettede forskerne PTBP1 med antisense-oligonukleotid (ASO)-baseret terapi, som i sidste ende undertrykte tumorvækst.
"Vores data fremhæver den rolle, som alternativ RNA-splejsning spiller i påvirdelsen af gliommalignitet og heterogenitet, og dens potentiale som en terapeutisk sårbarhed i behandlingen af voksne gliomer," skrev forfatterne af undersøgelsen.
Det næste skridt for forskerne er at undersøge potentialet for at målrette PTBP1 for at fremkalde et antitumorimmunrespons, sagde Song.
"Ved hjælp af long-read RNA-sekventeringsanalyse fandt vi, at målretning af PTBP1 i gliomceller resulterer i produktion af flere alternativt splejsede transkripter, der er fraværende i normalt væv. Så vores næste projekt er at finde ud af, om denne isoform kan generere nogle antigener, så immunsystemet bedre kan genkende tumoren," sagde Song.
Song tilføjede også, at deres team er interesseret i at analysere splejsningsændringer i ikke-tumorceller fra gliompatienter, såsom immunceller.
"Vi ved allerede, at splicing er meget vigtig for at regulere funktionen i cellen, så det bør ikke kun regulere tumormalignitet, men det kan også regulere immuncellernes funktion for at afgøre, om de effektivt kan dræbe kræft. Så vi laver også nogle bioinformatiske analyser i tumorinfiltrerede immunceller for at se, om der er en ændring i splicing, efter at en immuncelle har infiltreret tumoren."
"Vores mål er at bestemme rollen af alternativ splejsning i udformningen af det immunsuppressive tumormikromiljø og identificere potentielle mål for at forbedre effektiviteten af immunterapier i gliom," sagde Song.
