Nøgleprotein identificeret til at forhindre knogletab i osteoporose
Sidst revideret: 14.06.2024

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
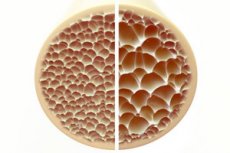
Osteoporose, en tilstand karakteriseret ved porøse og skøre knogler, udgør en betydelig trussel mod skeletets sundhed. Knogler, som er den vigtigste strukturelle støtte for den menneskelige krop, giver vital støtte. Når knoglemassen falder, forringer det ikke kun denne støtte, men forringer også den overordnede funktion, hvilket fører til nedsat livskvalitet.
I takt med at forekomsten af osteoporose stiger i den aldrende befolkning, øges belastningen af sundhedsressourcer til langtidspleje. Derfor er det nødvendigt at forstå de mekanismer, der bidrager til udviklingen af osteoporose og udvikle effektive målrettede behandlinger for at minimere dens langsigtede virkning.
Osteoblaster og osteoklaster er to typer celler, der spiller en nøglerolle i vedligeholdelsen og ombygningen af knoglevæv. Mens osteoblaster er knogledannende celler og er ansvarlige for syntesen og aflejringen af nyt knoglevæv, er osteoklaster knoglenedbrydende celler involveret i nedbrydning og fjernelse af gammelt eller beskadiget knoglevæv.
En stigning i andelen af osteoklaster fører til knogletab ved tilstande som osteoporose, leddegigt (betændelse i leddene) og knoglemetastaser (kræft, der har spredt sig til knoglerne). Osteoklaster opstår ved differentiering af makrofager eller monocytter, som er typer af immunceller.
Inhibering af osteoklastdifferentiering kan således tjene som en terapeutisk strategi til at forhindre knogletab. De præcise molekylære mekanismer, der regulerer den komplekse proces med knogleombygning, er dog stadig uklare.
I et nyt studie dykkede professor Tadayoshi Hayata, Mr. Takuto Konno og Ms. Hitomi Murachi fra Tokyo University of Science sammen med kolleger dybere ned i den molekylære regulering af osteoklastdifferentiering. Stimulering af receptor-nuklear faktor kappa B-aktivatorligand (RANKL) inducerer differentiering af makrofager til osteoklaster.
Derudover er knoglemorfogenetisk protein (BMP) og transformerende vækstfaktor (TGF)-β-signalveje blevet impliceret i reguleringen af RANKL-medieret osteoklastdifferentiering. I det aktuelle studie forsøgte forskerne at undersøge rollen af Ctdnep1, en fosfatase (et enzym, der fjerner fosfatgrupper), der rapporteres at undertrykke BMP- og TGF-β-signalvejene.
Undersøgelsen blev offentliggjort i tidsskriftet Biochemical and Biophysical Research Communications.
Professor Hayata udtaler: "RANKL fungerer som en 'accelerator' for osteoklastdifferentiering. At køre bil kræver ikke kun en speeder, men også bremser. Her fandt vi ud af, at Ctdnep1 fungerer som en 'bremse' i osteoklastdifferentiering." p>
Forskerne undersøgte først ekspressionen af Ctdnep1 i makrofager fra mus behandlet med RANKL og kontrolceller uden behandling. De bemærkede, at Ctdnep1-ekspression ikke ændrede sig som reaktion på RANKL-stimulering. Imidlertid var det lokaliseret i cytoplasmaet i granulær form i makrofager og differentieret til osteoklaster, forskelligt fra dets normale perinukleære lokalisering i andre celletyper, hvilket tyder på dets cytoplasmatiske funktion i osteoklastdifferentiering.
Derudover resulterede Ctdnep1 knockout (nedregulering af genet) i en stigning i antallet af osteoklaster, der var positive for tartrat-resistente sur fosfatase (TRAP), hvor TRAP er en markør for differentierede osteoklaster.
Ctdnep1 knockout resulterede i øget ekspression af nøgledifferentieringsmarkører, herunder "Nfatc1", en master transkriptionsfaktor induceret af RANKL til osteoklastdifferentiering. Disse resultater understøtter en "hæmmende funktion" af Ctdnep1, hvorved det negativt regulerer osteoklastdifferentiering. Desuden resulterede knockout af Ctdnep1 også i øget calciumphosphatabsorption, hvilket tyder på en hæmmende rolle for Ctdnep1 i knogleresorption.
Endelig, selvom Ctdnep1-knockout ikke ændrede BMP- og TGF-β-signalvejene, viste Ctdnep1-deficiente celler øgede niveauer af phosphorylerede (aktiverede) proteiner, der er produkter af RANKL-signalvejen. Disse resultater tyder på, at den undertrykkende effekt af Ctdnep1 på osteoklastdifferentiering muligvis ikke medieres gennem BMP- og TGF-β-signalvejene, men gennem negativ regulering af RANKL-signalvejen og Nfatc1-proteinniveauer.
Samlet set giver disse resultater ny indsigt i osteoklastdifferentieringsprocessen og identificerer potentielle terapeutiske mål, der kan bruges til at udvikle behandlinger rettet mod at reducere knogletab på grund af osteoklastoveraktivitet. Ud over sygdomme karakteriseret ved knogletab, er Ctdnep1 også blevet identificeret som en årsagsfaktor i medulloblastom, en hjernetumor i barndommen. Forfatterne er optimistiske over, at deres forskning kan udvides til andre menneskelige sygdomme ud over knoglemetabolisme.
Professor Hayata konkluderer: "Vores resultater tyder på, at Ctdnep1 er påkrævet for at forhindre overdreven osteoklastogenese. Disse resultater kan yderligere udvide viden om, hvordan phosphorylerings-dephosphoryleringsnetværket kontrollerer osteoklastdifferentiering og kan give nye terapeutiske strategier til behandling af knoglesygdomme forbundet med overdreven osteoklastaktivitet."
