LM11A-31-lægemidlet bremser udviklingen af Alzheimers sygdom i forsøg
Sidst revideret: 14.06.2024

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.

I en nylig undersøgelse offentliggjort i Nature Medicine gennemførte forskere et randomiseret, dobbeltblindt, placebokontrolleret fase 2a-forsøg for at undersøge sikkerheden og effektiviteten af LM11A-31 til behandling af Alzheimers sygdom (AD) gennem modulering af p75 neurotrofinreceptoren (p75NTR).
Sent opstået AD er den mest almindelige form for demens, karakteriseret ved synaptisk svigt, degeneration og tab af nerveceller. Selvom de to vigtigste lægemidler til behandling af AD retter sig mod akkumulering af unormalt amyloid-β- eller tau-protein, adresserer de kun en del af patofysiologien. En anden tilgang er at målrette mod receptorer og signalnetværk, der påvirker fundamentale biologiske veje. Prækliniske undersøgelser viser, at modulering af p75NTR med det nye lille molekyle LM11A-31 reducerer synaptisk tab forårsaget af amyloid og patologisk tau.
Beskrivelse af undersøgelsen
I dette randomiserede kliniske forsøg undersøgte forskere, om LM11A-31 kunne bremse udviklingen af Alzheimers sygdom ved at modulere p75NTR hos mennesker.
Undersøgelsesdeltagere fik orale kapsler af LM11A-31 i doser på 200 mg og 400 mg eller placebo i et forhold på 1:1:1 til 242 patienter med mild til moderat astma i 26 uger. Deltagerne havde biologisk bekræftet Alzheimers sygdom (cerebrospinalvæske amyloid β protein 42 (Aβ42) niveau under 550 ng/L eller Aβ42:β40 forhold under 0,89), diagnosticeret i henhold til McKhann kriterier, med Mini Psychiatric SE (MMSE) score på 18 til 26 Geriatrisk depressionsskala (GDS) scorer under 5,0, modificeret Hacinski iskæmisk skala (HIS) score ≤ 4,0, formel uddannelse ≥ 8 år og tidligere kognitiv tilbagegang ≥ 6 måneder.
Kvalificerede deltagere havde taget acetylcholinesterasehæmmere (AChEI'er) eller partielle NMDA-receptorantagonister ≥ 3 måneder før studiestart. De tog ikke ulovlige stoffer såsom antipsykotika, benzodiazepiner, antiepileptika, beroligende midler, centralt aktive antihypertensiva, nootropika (undtagen ginkgo biloba) eller analgetika indeholdende opioider.
Det primære resultat af undersøgelsen var lægemiddelsikkerhed og tolerabilitet vurderet af Columbia Suicidal Ideation and Behavior Severity Rating Scale (C-SSRS), vitale tegn, blodtryk og hæmatologiske parametre. Strukturel magnetisk resonansbilleddannelse (sMRI), fluorodeoxyglucose positron emissionstomografi (FDG-PET) og cerebrospinalvæske (CSF) biomarkører blev brugt til at vurdere sekundære kognitive resultater. AD-indikatorer inkluderede tau phosphoryleret ved Thr181, totalt tau-protein, Aβ40, Aβ42 og AChE-aktivitet. Holdet brugte en individualiseret neuropsykologisk test til at vurdere sekundære kognitive resultater ved baseline, uge 12 og 26.
Forskningsresultater
Undersøgelsen viste, at LM11A-31 var sikker og veltolereret uden væsentlige sikkerhedsproblemer. De mest almindelige bivirkninger omfattede hovedpine, diarré, eosinofili og nasopharyngitis, hvor gastrointestinale problemer og eosinofili var hovedårsagerne til seponering af lægemidlet. Der var flere seponeringer i 400 mg-gruppen sammenlignet med 200 mg- og placebogruppen. MR afslørede ingen bekymringer om lægemiddelsikkerhed, herunder amyloid-relaterede abnormiteter. Der var ingen signifikante forskelle i kognitive scores eller amyloidabnormiteter mellem de to behandlingsgrupper.
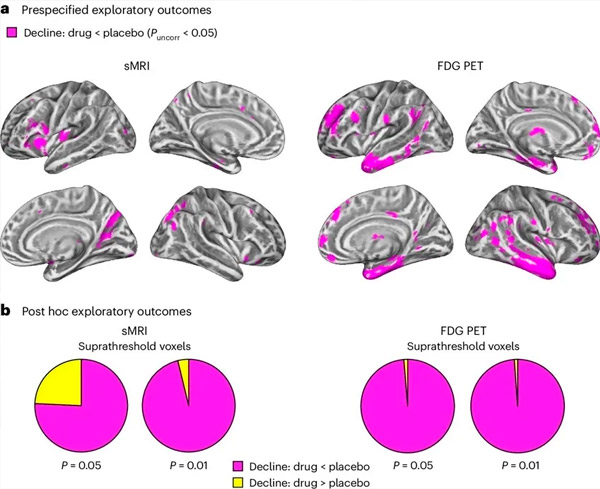
A. To-faktor blandede modeller analyser af kovarians undersøgte interaktioner mellem behandling (lægemiddel eller placebo) og tid (før eller efter behandling). En envejs t-kontrast, der undersøgte interaktionshypotesen (lægemidlet sænker progressionen sammenlignet med placebo) viste, at LM11A-31-behandling forsinkede langsgående degeneration (venstre paneler) og glucose-hypometabolisme (højre paneler) i den lægemiddelbehandlede gruppe (cMRI, n = 127; PET, n = 121), sammenlignet med placebogruppen (sMRI, n = 66; PET, n = 62). Voxels, der viser denne interaktion, vises ved den ukorrigerede tærskel P < 0,05 (magenta farve) på en populationsspecifik kortikal overflade. Venstre og højre halvkugle er vist i henholdsvis øverste og nederste række. Hjerneregioner, der viser interaktioner, der ikke er i overensstemmelse med hypotesen, er vist i figur 7 i de supplerende data. LM11A-31 reducerede effektivt stigningen i Aβ42 og Aβ40 i CSF sammenlignet med placebogruppen. Lægemidlet viste også et fald i den gennemsnitlige årlige procentvise ændring i den præsynaptiske proteinbiomarkør SNAP25 og et fald i den postsynaptiske biomarkør NG, hvilket indikerer en opbremsning i tabet af præsynaptiske og postsynaptiske forbindelser. LM11A-31 reducerede også YKL40-væksten, hvilket resulterede i nedsatte MMSE-scores og øgede ADAS-Cog-13-scores. Lægemidlet reducerede også tab af gråt stof i frontallappen og den bagerste parietale cortex og nedsatte glukosemetabolisme i områder som entorhinal cortex, temporal cortex, hippocampus, insular cortex og præfrontal cortex. Undersøgelsen konkluderede, at modulering af p75NTR med LM11A-31 er egnet til større kliniske forsøg. LM11A-31 opfyldte det primære sikkerhedskriterium og blev godt tolereret af patienter med milde til svære former for astma. Resultaterne indikerer behovet for yderligere undersøgelser med længere behandlingsvarighed for at evaluere gennemførligheden af at bruge små molekyler til at regulere p75NTR som en sygdomsmodificerende terapi i AD. Undersøgelsen viste, at LM11A-31 signifikant påvirkede flere biomarkører, herunder Aβ40, Aβ42, SNAP25, NG og YKL40, hvilket indikerer svækkelse af patologisk udvikling. Fremtidige undersøgelser kan evaluere yderligere indikatorer for glial sundhed.
b. Samlet antal voxels i foruddefinerede sårbare AD-hjerneregioner (samlet område af cirkeldiagrammer), der viser enten hypotese-konsistent interaktion (magent farve) eller hypotese-inkonsistent interaktion (gul farve) i hver af billeddannelsesmodaliteterne (cMRI, venstre panel; FDG PET, højre panel) ved stadig mere liberale ujusterede P-tærskler < 0,01 og P Konklusion
