Protein ansvarlig for genetisk inflammatorisk sygdom identificeret
Sidst revideret: 14.06.2024

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
Et team af forskere ledet af Dr. Hirotsugu Oda fra CECAD Cluster of Excellence for Aging Research ved University of Cologne har opdaget den rolle, som et specifikt proteinkompleks spiller i nogle former for immunforstyrrelser. Dette resultat kan føre til udviklingen af nye terapeutiske tilgange rettet mod at reducere autoinflation og "genoprette" immunsystemet hos patienter, der lider af genetisk dysfunktion af dette proteinkompleks.
Undersøgelsen "Biallelic human SHARPIN tab af funktion inducerer autoinflammation og immundefekt" blev offentliggjort i Nature Immunology.
Det lineære ubiquitin-samlende kompleks (LUBAC), sammensat af proteinerne HOIP, HOIL-1 og SHARPIN, har længe været anerkendt for dets kritiske rolle i at opretholde immunhomeostase. Tidligere undersøgelser på mus har vist alvorlige konsekvenser af tab af SHARPIN, hvilket fører til alvorlig dermatitis på grund af overdreven hudcelledød. De specifikke konsekvenser af SHARPIN-mangel på menneskers sundhed er dog indtil videre forblevet uklare.
Forskerholdet rapporterer for første gang om to mennesker med SHARPIN-mangel, som udviser symptomer på autoinflation og immundefekt, men som uventet ikke udviser dermatologiske problemer, som det ses hos mus.
Ved yderligere undersøgelse blev disse individer fundet at have et svækket kanonisk NF-KB-respons, en vej vigtig for immunrespons. De havde også øget følsomhed over for celledød forårsaget af medlemmer af tumornekrosefaktoren (TNF) superfamilien. Behandling af en af patienterne med SHARPIN-mangel med anti-TNF-terapi, som specifikt hæmmer TNF-induceret celledød, resulterede i fuldstændig opløsning af autoinflation på celleniveau og i klinisk præsentation.
Forskning viser, at overdreven og ukontrolleret celledød spiller en afgørende rolle i menneskelige genetiske inflammatoriske sygdomme. Odas team har tilføjet SHARPIN-mangel som et nyt medlem af en gruppe af genetiske menneskelige inflammatoriske sygdomme, som de foreslår at kalde "medfødte fejl ved celledød."
Beskyttelse mod immunforstyrrelser Undersøgelsen blev påbegyndt i laboratoriet af Dr. Dan Kastner ved National Institutes of Health (NIH) i USA. Forskere der var i stand til at observere en patient med uforklarlige episoder med feber, gigt, colitis og immundefekt i barndommen.
Efter at have indhentet informeret samtykke udførte de exome-sekventering på patienten og hans familie og opdagede, at patienten havde en forstyrrende genetisk variant i SHARPIN-genet, der førte til uopdagelige niveauer af SHARPIN-protein. De fandt også, at patientceller viste en øget tilbøjelighed til at dø i både dyrkede celler og patientbiopsier.
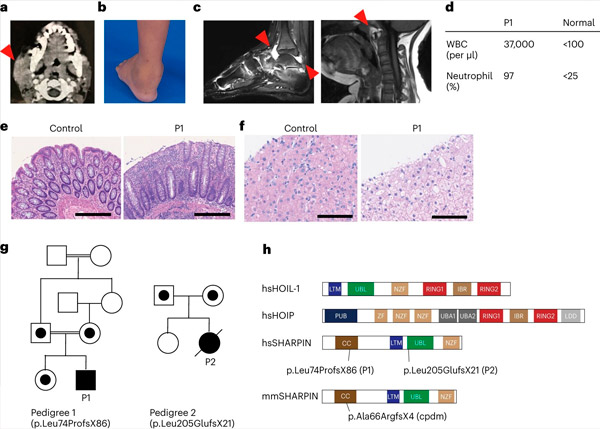
SHARPIN-mangel hos mennesker forårsager autoinflammation og leverglykogenose. Kilde: Nature Immunology (2024). DOI: 10.1038/s41590-024-01817-w
Teamet fandt også ud af, at udviklingen af lymfoide germinale centre - specialiserede mikrostrukturer i adenoiderne, som er kritiske for modningen af vores immunsystems B-celler og derfor produktionen af antistoffer - blev signifikant reduceret på grund af øget B-celledød. Disse resultater forklarer immundefekten hos patienter og fremhæver LUBAC's vigtige rolle i at opretholde immunhomeostase hos mennesker.
"Vores undersøgelse fremhæver den kritiske betydning af LUBAC til at beskytte mod immunforstyrrelser. Ved at belyse de molekylære mekanismer, der ligger til grund for LUBAC-mangel, baner vi vejen for nye terapeutiske strategier, der sigter mod at genoprette immunhomeostase,” sagde Oda, hovedforfatter af undersøgelsen.
Han tilføjede: "En af patienterne med SHARPIN-mangel havde været kørestolsafhængig i mange år, før vi så ham første gang. Hans ankler var ømme, og det var for smertefuldt at gå. Den genetiske diagnose gjorde det muligt for os at målrette den korrekte molekylære vej, der ligger til grund for hans tilstand."
Siden patienten begyndte at modtage anti-TNF-behandling, har han været symptomfri i næsten syv år. "Som kliniker og videnskabsmand er jeg glad for at have muligheden for at påvirke én patients liv positivt gennem vores forskning," konkluderede Oda.
