Nye publikationer
Forskere har skabt en 'kamæleon'-forbindelse til behandling af medicinresistent hjernekræft
Sidst revideret: 02.07.2025

Alt iLive-indhold gennemgås medie eller kontrolleres for at sikre så meget faktuel nøjagtighed som muligt.
Vi har strenge sourcing retningslinjer og kun link til velrenommerede medie websteder, akademiske forskningsinstitutioner og, når det er muligt, medicinsk peer reviewed undersøgelser. Bemærk at tallene inden for parentes ([1], [2] osv.) Er klikbare links til disse undersøgelser.
Hvis du mener, at noget af vores indhold er unøjagtigt, forældet eller på anden måde tvivlsomt, skal du vælge det og trykke på Ctrl + Enter.
En ny undersøgelse foretaget af forskere fra Yale University beskriver, hvordan en ny kemisk forbindelse angriber lægemiddelresistente hjernetumorer uden at skade sundt omgivende væv.
Undersøgelsen, der er offentliggjort i Journal of the American Chemical Society, er et vigtigt skridt i udviklingen af såkaldte "kamæleonforbindelser", der kan bruges til at bekæmpe en række farlige kræftformer.
Gliomer udvikler sig hos cirka 6,6 pr. 100.000 personer hvert år og hos 2,94 pr. 100.000 personer inden 14-årsalderen. Bortset fra metastaser fra andre kræftformer, der når centralnervesystemet, tegner gliomer sig for 26 % af alle hjernetumorer (primære hjernetumorer) og 81 % af alle maligne hjernetumorer.
I årtier er patienter med glioblastom blevet behandlet med et lægemiddel kaldet temozolomid. De fleste patienter udvikler dog resistens over for temozolomid inden for et år. Femårsoverlevelsesraten for patienter med glioblastom er mindre end 5 %.
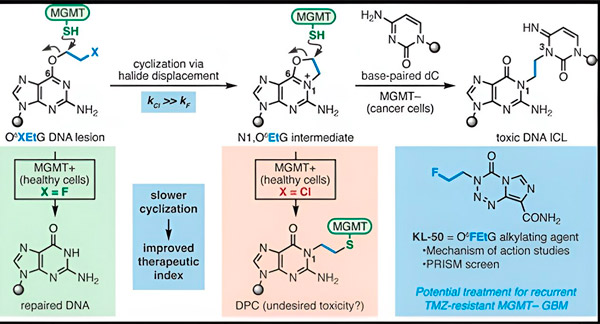
I 2022 udviklede Yale-kemikeren Seth Herzon og stråleterapeuten Dr. Ranjit Bindra en ny strategi til mere effektiv behandling af glioblastomer. De skabte en klasse af antikræftmolekyler kaldet kamæleonforbindelser, der udnytter en defekt i et DNA-reparationsprotein kendt som O6-methylguanin-DNA-methyltransferase (MGMT).
Mange kræftceller, herunder glioblastomer, mangler MGMT-proteinet. Nye kamæleonforbindelser er designet til at beskadige DNA i tumorceller, der mangler MGMT.
Kamæleonforbindelser initierer DNA-skade ved at aflejre primære læsioner på DNA, som over tid udvikler sig til meget giftige sekundære læsioner kendt som interstrand-tværbindinger. MGMT beskytter DNA'et i sundt væv ved at reparere primære læsioner, før de kan udvikle sig til dødelige interstrand-tværbindinger.
I deres nye undersøgelse fokuserede medforfatterne Herzon og Bindra på deres førende kamæleon, KL-50.
"Vi brugte en kombination af syntetisk kemi og molekylærbiologiske studier til at belyse det molekylære grundlag for vores tidligere observationer, såvel som den kemiske kinetik, der giver den unikke selektivitet af disse forbindelser," sagde Herzon, Milton Harris-professor i kemi ved Yale. "Vi viser, at KL-50 er unik, idet den kun danner DNA-tværbindinger i tumorer med defekt DNA-reparation. Det skåner sundt væv."
Kilde: Journal of the American Chemical Society (2024). DOI: 10.1021/jacs.3c06483
Det er en betydelig forskel, påpeger forskerne. En række andre kræftbekæmpende forbindelser er blevet designet til at udløse tværbindinger mellem strenge, men de er ikke selektive for tumorceller, hvilket begrænser deres anvendelighed.
Hemmeligheden bag KL-50's succes er dens timing, bemærkede forskerne. KL-50 danner interstrand-tværbindinger langsommere end andre tværbindingsmidler. Denne forsinkelse giver raske celler nok tid til at bruge MGMT til at forhindre dannelse af tværbindinger.
"Denne unikke profil antyder dens potentiale til behandling af lægemiddelresistent glioblastom, et område med et stort udækket behov i klinikken," sagde Bindra, Harvey og Kate Cushing-professor i terapeutisk radiologi ved Yale School of Medicine. Bindra er også videnskabelig leder af Chenevert Family Brain Tumor Center på Smilo Hospital.
Herzon og Bindra sagde, at deres undersøgelse fremhæver vigtigheden af at overveje hastigheden af kemisk DNA-modifikation og biokemisk DNA-reparation. De mener, at de kan bruge denne strategi til at udvikle behandlinger for andre kræftformer, der indeholder specifikke tumorassocierede DNA-reparationsdefekter.
